运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)已知:1/2O2(g)=1/2O2+(g)+1/2e- △H1=587.9kJ/mol K1
PtF6(g)+e-=PtF6-(g) △H2=-771.1kJ/mol K2
O2+PtF6-(s)=O2+(g)+PtF6-(g) △H3=482.2kJ/mol K3
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=________,K=_______(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示。
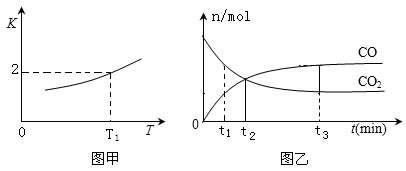
①T℃、p Pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是_____。
A.混合气体的平均相对分子质量不再变化
B.容器内压强不再变化
C.v正(CO2)=v逆(FeO)
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为_____,平衡时混合气体的密度与起始时气体的密度之比为_______。
(3)在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及特定平衡状态见下表。
2NH3,有关数据及特定平衡状态见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2molN2 |
3molH2 |
0molNH3 |
1.5molNH3 |
同种物质的体积分数相同 |
| 乙 |
amolN2 |
bmolH2 |
0molNH3 |
1.2molNH3 |
起始时乙容器中的压强是甲容器的____倍。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号