19世纪中叶,门捷列夫的突出贡献是( )。
| A.提出原子学说 | B.发现元素周期律 | C.提出分子学说 | D.发现氧气 |
若室温时,pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则氨水的电离度可表示为( )
| A.10(12-a-b)% | B.10(a+b-14) | C.10(a+b-12)% | D.10(14-a-b) |
在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力如图1-14-1所示,请回答:
(1)“0”点导电能力为0的理由______。
(2)a,b,c三点溶液的pH值由小到大的顺序为______。
(3)a,b,c三点中电离度最大的是:______。
(4)若使c点溶液中[CH3COO-]增大,溶液的pH值也增大,可采取的措施为:
①______;②______;③______。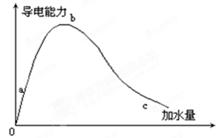
金属镁和0.1mol·L-1的HCl反应制取氢气,反应速率过快不易收集。为了减缓反应速率,又不减少产生氢气的量,加入下列试剂不能达到上述要求的是
| A.硫酸钠溶液 | B.醋酸钠固体 |
| C.碳酸钠固体 | D.水 |
弱酸HY溶液的pH=3,弱酸HZ溶液的pH=4,两者浓度相近,将两溶液等体积混合后的pH范围是
| A.3.0~3.3 | B.3.3~3.5 | C.3.5~4.0 | D.3.7~4.3 |
同温下两种稀碱水溶液,碱甲溶液的物质的量浓度为c1,电离度为a1;碱乙溶液的量浓度为c2,电离度为a2,已知甲溶液的pH值小于乙溶液的pH值,下列有关叙述正确的是( )
| A.c1>c2 | B.a1<a2 | C.碱性:甲<乙 | D.无法判断 |
一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体) Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
| A.溶液中钡离子数目减小 |
| B.溶液中钡离子浓度减小 |
| C.溶液中氢氧根离子浓度增大 |
| D.pH值减小 |
将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性稍有变化但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是:
| A.NaOH溶液 | B.蒸馏水 | C.Na2SO3溶液 | D.KI溶液 |
如图所示为某教材中给出的石英晶体平面结构示意图,它实际上是立体网状结构(可以看作是晶体硅中的每个Si-Si键中插入一个O),其中硅与氧原子个数之比是__________________________;在石英晶体中,由硅、氧原子构成的最小的环上具有的Si、O原子个数是_______________________________________。
X,Y两元素为主族元素,它们可形成XY型的离子化合物,若Xm+和Ym-离子的核外电子数总和为20,则X、Y在周期表中的位置可以是( )
| A.X,Y在同一周期 |
| B.X,Y在同一主族 |
| C.相邻周期相隔一个主族的两短周期元素 |
| D.相邻周期相隔数个主族的短周期元素 |
下面叙述正确的是( )
| A.同族非金属元素,自上而下所形成的酸,其酸性渐弱,因为成酸元素的非金属性渐弱 |
| B.同族非金属的最低价阴离子,由上而下其还原性渐强,而氧化性渐弱 |
| C.同主族元素的单质,金属则越向下熔点基本上越低,非金属则越高 |
| D.元素周期表中Ⅲ B族的元素种类最多 |
下列各叙述中正确的是( )
| A.在氯化钠晶体中,每个Na+周围有6个Cl-,形成离子晶体 |
| B.在氯化钠晶体中存在NaCl分子 |
| C.石英是由SiO2形成的分子晶体 |
| D.金刚石和石墨晶体都是由碳原子形成的网状结构,是典型的原子晶体 |
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
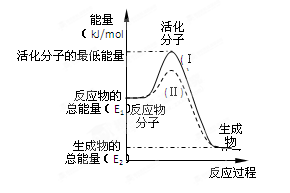
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,该反应的△H =________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+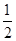 O2(g) = H2O(g) △H =" -" 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
O2(g) = H2O(g) △H =" -" 241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
试题篮
()