重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:
上述反应配平后 与 的系数比为________。该步骤不能使用陶瓷容器,原因是________。
(2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的 使之变________(填"大"或"小"),原因是________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向"滤液3"中加入适量 ,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到________(填标号)得到的 固体产品最多。
a.
b.
c.
d.
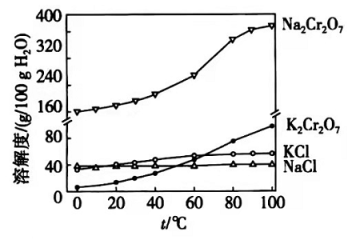
步骤⑤的反应类型是________。
(5)某工厂用 铬铁矿粉(含 40%)制备 ,最终得到产品 ,产率为________。
立德粉
(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
| A. |
黄色 |
| B. |
红色 |
| C. |
紫色 |
| D. |
绿色 |
(2)以重晶石( )为原料,可按如下工艺生产立德粉:
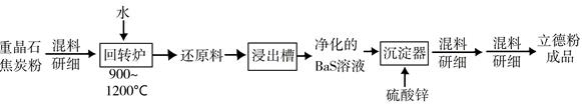
①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为 和一种清洁能源气体,该反应的化学方程式为________。
②在潮湿空气中长期放置的"还原料",会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是"还原料"表面生成了难溶于水的________(填化学式)。
③沉淀器中反应的离子方程式为________。
(3)成品中 的含量可以用"碘量法"测得。称取 样品,置于碘量瓶中,移取 l的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应 ,有单质硫析出。以淀粉溶液为指示剂,过量的 用 溶液滴定,反应式为 。测定时消耗 溶液体积 。终点颜色变化为________,样品中 的含量为________(写出表达式)。
醋酸亚铬[ ]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是________,仪器a的名称是________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开 , ,关闭 。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为________。
②同时c中有气体产生,该气体的作用是________。
(3)打开 ,关闭 和 。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是________、________、洗涤、干燥。
(4)指出装置d可能存在的缺点________。
和 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 , 还含有少量MgO、 等杂质)来制备,工艺流程如下:
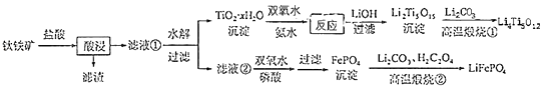
回答下列问题:
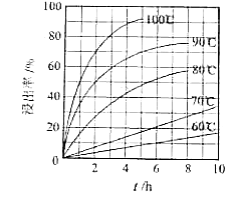
(1)"酸浸"实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为________.
(2)"酸浸"后,钛主要以 形式存在,写出相应反应的离子方程式________.
(3) 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
|
温度/℃ |
30 |
35 |
40 |
45 |
50 |
|
92 |
95 |
97 |
93 |
88 |
分析40℃时 转化率最高的原因________.
(4) 中Ti的化合价为+4,其中过氧键的数目为________.
(5)若"滤液②"中 , 加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中 , 此时是否有 沉淀生成?________(列式计算). 、 的分别为 、
(6)写出"高温煅烧②"中由FePO 4制备 的化学方程式________.
双氧水是一种重要的氧化剂、漂白剂和消毒剂.生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
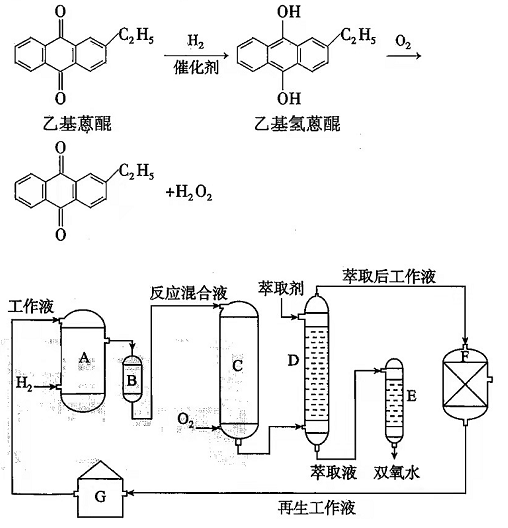
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水.回答下列问题:
(1)蒽醌法制备H 2O 2理论上消耗的原料是________,循环使用的原料是________,配制工作液时采用有机溶剂而不采用水的原因是________.
(2)氢化物A中反应的化学方程式为________.进入氧化塔C的反应混合液中的主要溶质为________.
(3)萃取塔D中的萃取剂是________,选择其作萃取剂的原因是________.
(4)工作液再生装置F中要除净残留的H 2O 2, 原因是________.
(5)双氧水浓度可在酸性条件下用KMnO 4溶液测定,该反应的离子方程式为________,一种双氧水的质量分数为27.5%(密度为1.10g•cm ﹣ 3),其浓度为________mol•L ﹣ 1.
某班同学用如下实验探究Fe2+、Fe3+的性质.回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L 的溶液.在FeCl2溶液中需加入少量铁屑,其目的是________.
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化.FeCl2溶液与氯水反应的离子方程式为________.
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________.
(4)丙组同学取10mL 0.1mol•L﹣1KI溶液,加入6mL 0.1mol•L﹣1 FeCl3溶液混合.分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红.
实验②检验的离子是________(填离子符号);实验①和③说明:在I﹣过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________.
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是________,生成沉淀的原因是________(用平衡移动原理解释).
以硅藻土为载体的五氧化二钒( )是接触法生产硫酸的催化剂.从废钒催化剂中回收 既避免污染环境又有利于资源综合利用.废钒催化剂的主要成分为:
|
物质 |
|
|
|
|
|
|
|
质量分数/% |
2.2~2.9 |
2.8~3.1 |
22~28 |
60~65 |
1~2 |
<1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)"酸浸"时 转化为 , 反应的离子方程式为________,同时 转成 . "废渣1"的主要成分是________.
(2)"氧化"中欲使 的 变为 , 则需要氧化剂 至少为________mol.
(3)"中和"作用之一是使钒以 形式存在于溶液中."废渣2"中含有________.
(4)"离子交换"和"洗脱"可简单表示为: (以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈________性(填"酸""碱""中").
(5)"流出液"中阳离子最多的是________.
(6)"沉钒"得到偏钒酸铵( )沉淀,写出"煅烧"中发生反应的化学方程式________.
煤燃烧排放的烟含有 和 , 形成酸雨、污染大气,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1) 的化学名称为________.
(2)在鼓泡反应器中通入含 、 的烟气,反应温度323K, 溶液浓度为 . 反应一段时间后溶液中离子浓度的分析结果如表.
|
离子 |
|
|
|
|
|
|
c/ |
|
|
|
|
|
①写出 溶液脱硝过程中主要反应的离子方程式________.增加压强,NO的转化率________(填"提高"、"不变"或"降低").
②随着吸收反应的进行,吸收剂溶液的pH逐渐________(填"增大"、"不变"或"减小").
③由实验结果可知,脱硫反应速率________脱硝反应速率(填"大于"或"小于")原因是除了 和NO在烟气中初始浓度不同,还可能是________.
(3)在不同温度下, 溶液脱硫、脱硝的反应中 和NO的平衡分压 如图所示.
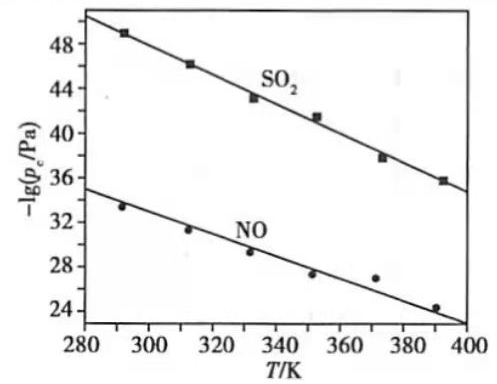
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______(填"增大"、"不变"或"减小").
②反应 的平衡常数K表达式为________.
(4)如果采用 、 替代 ,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析, 相比 具有的优点是________.
②已知下列反应:
则反应 (aq)的△H=________.
硼酸
是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
及少量
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
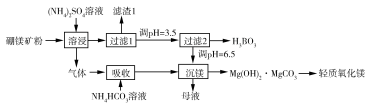
回答下列问题:
(1)在 "溶侵"硼镁矿粉,产生的气体在"吸收"中反应的化学方程式为_________。
(2)"滤渣1"的主要成分有_________。为检验"过滤1"后的滤液中是否含有 离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应: , ,可判断 是_______酸;在"过滤2"前,将溶液pH调节至3.5,目的是_______________。
(4)在"沉镁"中生成 沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
元素铬(Cr)在溶液中主要以 (蓝紫色)、 (绿色)、 (橙红色)、 (黄色)等形式存在, 为难溶于水的灰蓝色固体, 回答下列问题:
(1) 与 的化学性质相似,在 溶液中逐滴加入 溶液直至过量, 可观察到的现象是 。
(2) 和 在溶液中可相互转化。室温下,初始浓度为 的 溶液中 随 的变化如图所示。

①用离子方程式表示 溶液中的转化反应____________。
②由图可知,溶液酸性增大, 的平衡转化率__________(填"增大"减小"或"不变")。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中 的平衡转化率减小,则该反应的 _________(填"大于""小于"或"等于")。
(3)在化学分析中采用 为指示剂,以 标准溶液滴定溶液中的Cl −,利用Ag +与 生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好完全沉淀(浓度等于 )时,溶液中 为_______ ,此时溶液中 等于__________ 。(已知 、 的 分别为 和 )。
(4)+6价铬的化合物毒性较大,常用 将废液中的 还原成 ,反应的离子方程式为______________。
下列过程中的化学反应,相应的离子方程式正确的是( )
| A. |
用碳酸钠溶液处理水垢中的硫酸钙: |
| B. |
过量铁粉加入稀硝酸中: |
| C. |
硫酸铝溶液中滴加少量氢氧化钾溶液: |
| D. |
氯化铜溶液中通入硫化氢: |
碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
①加入 粉进行转化反应的离子方程式为_________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为__________;若反应物用量比 时,氧化产物为_________;当 ,单质碘的收率会降低,原因是___________。
(2)以 为原料制备 的方法是:先向 溶液中加入计量的 ,生成碘化物;再向混合溶液中加入 溶液,反应得到 ,上述制备 的总反应的离子方程式为__________。
(3) 溶液和 溶液混合可生成 沉淀和 ,若生成 ,消耗的 至少为_______ 。 在 溶液中可发生反应: 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是________。
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3 )和BaS制备高纯MnCO3的工艺流程如图:
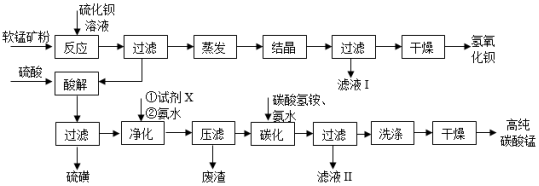
已知:MnO2是一种两性氧化物; 25℃时相关物质的Ksp见下表。
|
物质 |
Fe(OH)2 |
Fe(OH)3 |
Al(OH)3 |
Mn(OH)2 |
|
Ksp |
1×10﹣16.3 |
1×10﹣38.6 |
1×10﹣32.3 |
1×10﹣12.7 |
回答下列问题:
(1)软锰矿预先粉碎的目的是 ,MnO2 与BaS溶液反应转化为MnO的化学方程式为 。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是 。
(3)滤液Ⅰ可循环使用,应当将其导入到 操作中 (填操作单元的名称)。
(4)净化时需先加入的试剂X为 (填化学式),再使用氨水调溶液的pH,则pH的理论最小值为 (当溶液中某离子浓度c≤1.0×10﹣5mol•L﹣1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为 。
对于下列实验,能正确描述其反应的离子方程式是( )
A.用Na2SO3溶液吸收少量Cl2:3SO32﹣+Cl2+H2O═2HSO3﹣+2Cl﹣+SO42﹣
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2═O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:NH4++OH﹣═NH3•H2O
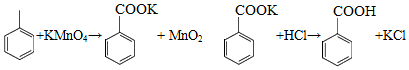
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
|
名称 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
密度/(g•mL﹣1) |
溶解性 |
|
甲苯 |
92 |
﹣95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
|
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
﹣﹣ |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g (约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol•L﹣1的KOH标准溶液滴定,三次滴定平均消耗21.50mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
A.100mL B.250mL C.500mL D.1000mL
(2)在反应装置中应选用 冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是 。
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
(6)本实验制备的苯甲酸的纯度为 ; 据此估算本实验中苯甲酸的产率最接近于 (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中 的方法提纯。
试题篮
()