题文
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用。某科学研究性学习小组利用以下装置完成测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
实验原理:2Na2CO4 + 4HCl ="====" 4NaCl + 2CO2↑+ O2↑+ 2H2O
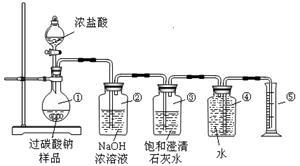
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度。
(1)装置②的作用是:
(2)称取适量样品与足量浓盐酸充分反应后,收集到氧气的体积为0.25 L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品中过碳酸钠(Na2CO4)的质量为 g;
Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是 ;(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
Ⅲ.丙同学提出了一种新方案,称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7 g,则该样品的纯度为多少?








 粤公网安备 44130202000953号
粤公网安备 44130202000953号