下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化为I2。它们的转化关系如下:(有些反应的条件和部分产物为注明)
(1)写出下列物质化学式:B_________,F_______________;
(2)写出反应①的化学方程式:____________________;
(3)H在空气中很容易被氧化为I,该过程的实验现象是__________________;
(4)将足量的CO2通入E溶液中,离子方程式是___________________。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有__________。
| A.具有丁达尔现象 |
| B.红褐色液体可用过滤的方法纯化 |
| C.液体中分散质微粒直径小于1nm |
| D.取适量液体加入K2SO4溶液会产生红褐色沉淀 |
某溶液中可能存在下列离子:NH4+、Fe2+、Cl-、SO42-、CO32-中的一种或几种,某同学为了检验它们的存在,进行了如下实验:
①取少量该溶液加入过量的Ba(NO3)2溶液,产生白色沉淀,过滤,得沉淀和滤液;
②向①的沉淀中加入足量的稀硝酸,发现沉淀不溶解;
③向①的滤液中加入硝酸银溶液,未见白色沉淀;
④再取少量原溶液加入2滴KSCN溶液,无明显现象,继续加入氯水,溶液立即变为血红色。
(1)则原溶液中一定存在的离子是______________;
(2)一定不存在的离子是______________;
(3)可能存在的离子是_________,为进一步确定该离子是否存在,该同学还应补做的实验是___________。
将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况下)。
(1)写出上述过程中,有关反应的离子方程式______________、_____________。
(2)完成该反应至少需要量取10mol/L的浓硝酸__________mL。
(3)混合气体中NO2的体积为__________L,NO的体积为__________L(均为标准状况下)。
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____________mol。
Fe和Fe2O3的混合物15g,加入150mL稀硫酸中,标准状况下放出H21.68L,同时固体全部溶解。向溶液中滴加硫氰化钾溶液后,未见颜色变化。若向溶液中加入3mol/LNaOH溶液200mL,恰好使铁元素全部沉淀。则该稀硫酸的物质的量浓度为( )
| A.2.25mol/L | B.2mol/L | C.0.6mol/L | D.0.3mol/L |
将铝粉与Fe3O4粉末配制成铝热剂(铝与铁的氧化物的反应称为铝热反应,产物是铁和氧化铝),分成三等份。①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;②一份在高温下恰好反应完全,将反应后的混合物与足量的盐酸混合,放出的气体在标准状况下的体积为V2;③一份直接放入足量的盐酸中,充分反应后放出的气体在标准状况下的体积为V3。下列说法正确的是( )
| A.V1=V3>V2 | B.V2>V1=V3 | C.V1=V2>V3 | D.V1>V3>V2 |
铜镁合金9.2g完全溶于浓硝酸中,反应中硝酸钡还原只产生10304mL(标准状况下)NO2气体。向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A.16.51g | B.23.82g | C.24.84g | D.17.02g |
下列离子方程式书写正确的是( )
| A.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B.碳酸钠溶液与硫酸氢钠溶液反应:CO32-+H+=CO2↑+H2O |
| C.Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D.向FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
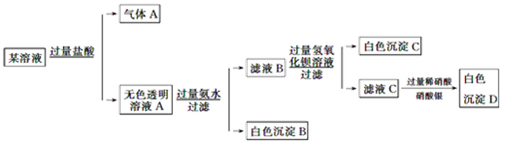
下列说法正确的是( )
| A.原溶液中一定存在AlO2-、CO32-、SO42-、Cl-四种离子 |
| B.原溶液中是否存在Na+无法判断 |
| C.原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ |
| D.生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓ |
有50mL某气体,可能含有CO2、O2、NH3中的一种或几种,将其通过浓H2SO4没有发现体积变化。通过足量Na2O2后,体积变为30mL,则该气体可能为( )
| A.CO2为20mL,NH3为30mL | B.NH3为40mL,O2为10mL |
| C.CO2为30mL,O2为20mL | D.CO2为40mL,O2为10mL |
将0.15molFe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
某学生做如下实验:第一步,在淀粉-KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的是
| A.氧化性:ClO->I2>SO42- |
| B.若将Na2SO3溶液加入氯水中,氯水褪色 |
| C.淀粉-KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 |
| D.蓝色消失的原因是Na2SO3溶液具有漂白性 |
A、B是中学化学里常用的物质,其中B是单质,A是化合物;F是红棕色气体,I是红褐色沉淀。它们之间相互反应以及生成物之间的转化关系如图所示。已知,I、L两种物质中除了含不同价态的B元素外,还都含另外两种相同的元素(这两种元素的原子序数均小于18)。请回答:

(1)B和A的浓溶液在常温下难反应,原因是_____________。但加热后,却可以,请写出反应的化学方程式: 。
(2)写出F和G相互转化的化学方程式:
F→G ;
A→H 。
(3)L转化成I的现象是 ;有关的化学方程式 。
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置。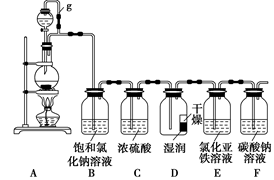
请回答下列问题:
(1)写出实验室制氯气的离子方程式: 。
(2)装置A中g管作用是___________,装置B的作用是 ,装置C的作用是 。
(3)反应一段时间后用注射器从E中抽取少量溶液,检验有Fe3+生成,请写出检验方法________。
(4)已知HCO3-的酸性弱于次氯酸,请写出少量的氯气与F中足量的碳酸钠溶液反应的化学方程式:______________________。
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式是________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________。
(3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为______________。某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________。
试题篮
()