向体积为Va的0.05 mol·L-1CH3COOH溶液中加入体积为Vb的0.05 mol·L-1KOH溶液,下列关系错误的是
| A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) |
| B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-) |
| C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) |
| D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
将足量的铜片与100ml、18mol/L浓硫酸加热充分反应,收集到标准状况下的SO2气体VL。下列对此反应的有关说法中错误的是
| A.该反应体现了浓硫酸的酸性和强氧化性 | B.参加反应的铜为0.9mol |
| C.反应结束后两种反应物均有剩余 | D.被还原的硫酸为V/22.4mol |
ClO2是一种消毒杀菌效率高,二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
| A.1mol KClO3参加反应有2mol电子转移 | B.H2C2O4在反应中被还原 |
| C.还原性:H2C2O4 > ClO2 | D.ClO2是氧化产物 |
关于下列各装置图的叙述中,正确的是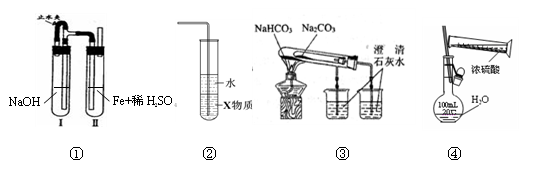
| A.用装置①可制备氢氧化亚铁并长时间观察其颜色 |
| B.装置②中X若为四氯化碳,可用于吸收HCl气体,并防止倒吸 |
| C.装置③验证Na2CO3和NaHCO3两种固体的热稳定性 |
| D.通过④的方法配制一定浓度的稀硫酸溶液 |
2015年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H =-867kJ·mol-1
2NO2(g)  N2O4(g) △H =-56.9kJ·mol-1
N2O4(g) △H =-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。

写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a)。
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH) 2 |
Cu(OH) 2 |
Fe(OH) 2 |
Fe(OH) 3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子,例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是_________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为:
(2)A中的碳原子是否都处于同一平面 (填“是”或“不是”);
(3)在下图中,D1、D2互为同分异构体,E1 、E2互为同分异构体。

反应②的化学方程式为:____________________
C的化学名称为:_________________
E2的结构简式是:_________________
④、⑥的反应类型依次是:_____________,_______________
(1)某烯烃,经与氢气加成反应可得到结构简式为
的烷烃,则此烯烃可能的结构简式是:___________、___________、___________。
(2)有A、B、C、D、E 5种烃,各取0.01 mol充分燃烧后,B、C、E所产生的二氧化碳均为448 mL(标准状况);A或D燃烧所得的二氧化碳都是前者的3倍。在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,其中A 可以转化为D,B可以转变为C或E,C可以转变为E;B或C都能使高锰酸钾酸性溶液褪色,而A、D、E无此性质;在铁屑存在时A与溴发生取代反应。
①写出烃的结构简式:B是___________, C是___________,D是___________, E是___________。
②写出A与溴反应方程式______________________________
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是( )
| A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是( )
| A.溶液中由水电离产生的H+浓度为1×10-7 mol/L |
| B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L |
| C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度 |
| D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算(写出计算过程):
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如下图所示(夹持装置略去)
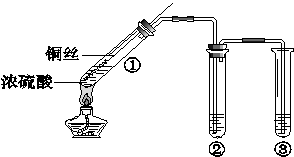
(1)试管①中反应的化学方程式是 。该反应表明浓硫酸具有 (填序号)。
a.酸性 b.强氧化性 c.还原性
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是 ,说明试管①中生成的气体具有 性。
(3)若试管②中的试剂为酸化的Ba(NO3)2溶液,观察到生成不溶于硝酸的白色沉淀,说明试管①中生成的气体具有 性。
(4)试管③中的试剂为NaOH溶液,反应的离子方程式是 。
已知B为黑色粉末,用D、E、G做焰色反应实验,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示。
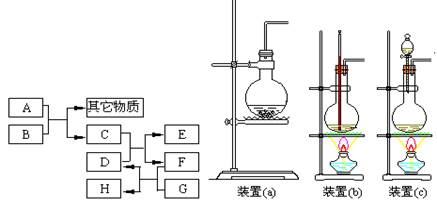
(1)请根据以上关系进行判断,指出下列物质的化学式:
A ,C ,D ,G .
(2)写出下列反应的化学方程式:
C+D: ;
A+B: 。
在A和B的反应中,A显示出来的性质是 (填写序号,多选倒扣)。
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性
当A和B进行反应时,应选择上图所示装置中的 较为合适。
(3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为 。
草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾等。现从某草木灰样品中提取钾盐,并检验其中的CO32-、SO42-和Cl-。
(1)从草木灰中提取钾盐的实验操作步骤如下,请补充完整:
① ②过滤 ③蒸发浓缩 ④冷却结晶 ⑤过滤。
(2)上述操作中需要用到玻璃棒的是 (填序号)。
(3)将制得的少量晶体加水溶解后,分别置于三支试管中。
①向第一支试管中加入少量稀盐酸,可观察到 ,说明溶液中存在 离子。
②向第二支试管中加入 ,可观察到 ,说明溶液中存在SO42-。③向第三支试管中先加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量 溶液,可观察到白色沉淀,说明溶液中存在Cl-。其中,加入足量Ba(NO3)2溶液的目的是 。
(Ⅰ)实验室中盐酸的用途十分广泛,常用来制备气体。
(1)某小组同学欲配制230mL0.4mol/L盐酸,则需取用4mol/L盐酸_________mL,实验中需要用到的玻璃仪器有___________、___________、量筒、烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是___________。
| A.容量瓶洗涤后未干燥 |
| B.移液时,有少量溶液溅出 |
| C.定容时,加水不慎超出刻度线,又倒出一些 |
| D.量取溶液时,仰视刻度线 |
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气。已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。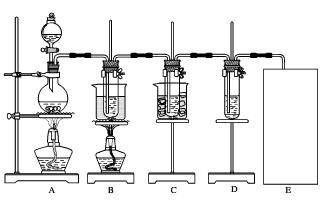
图中:A为氯气发生装置;B的试管里盛有15mL30%KOH溶液,并置于水浴中;C的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;D的试管里盛有紫色石蕊试液。
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过__________(填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式是__________________。
(2)制取氯酸钾是在装置B中进行的,装置B中制取氯酸钾的化学反应方程式是___________。该小组同学发现制得的氯酸钾产量偏低,原因是氯气中含有杂质,改进方法是_________。
(3)实验中装置D的试管中产生的现象是_______________。
(4)请在装置图方框中画出上述实验还缺少的装置,并注明试剂。
(5)该小组同学认为:SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。但是如果将SO2和Cl2同时通入到品红溶液中,则会发现褪色效果并不像该小组同学想象的那样。请你分析原因(用离子方程式表示)____________________。
试题篮
()