)化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如图:
(1)A中的含氧官能团名称为硝基、 和 。
(2)B的结构简式为 。
(3)C→D的反应类型为 。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α﹣氨基酸,另一产物分子中不同化学环境的氢原子数目比为1:1且含苯环。
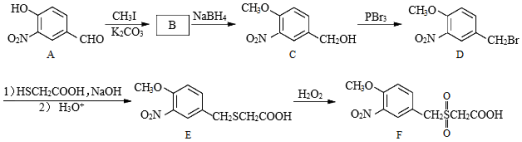
(5)写出以CH3CH2CHO和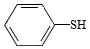 为原料制备
为原料制备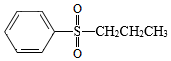 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
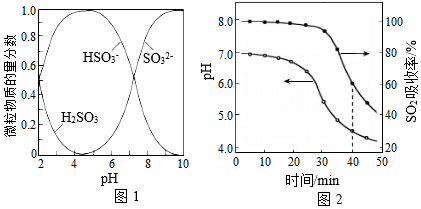
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3﹣、SO32﹣的物质的量分数随pH的分布如图1所示。
(1)氨水吸收SO2.向氨水中通入少量SO2,主要反应的离子方程式为 ;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是 (填化学式)。
(2)ZnO水悬浊液吸收SO2.向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(如图2)。溶液pH几乎不变阶段,主要产物是 ( 填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为 。
(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低SO42﹣生成速率越大,其主要原因是 ;随着氧化的进行,溶液的pH将 (填“增大”、“减小”或“不变“)。
作为一种绿色消毒剂,H2O2在公共卫生事业中发挥了重要的作用。已知反应:H2O2(l)═H2O(1) O2(g)△H=﹣98 kJ•mol﹣1 K=2.88×1020回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)═H2O(g) O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上 (填“放出”或“吸收”)热量 98kJ (填“大于”、“小于”或“等于”)。
(3)纯H2O2相对稳定,实验表明在54℃下恒温贮存2周,浓度仍能保持99%,原因是H2O2分解反应的 (填编号)。
a.△H比较小
b.K不够大
c.速率比较小
d.活化能比较大
(4)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起 作用。某组实验数据如下表:
t/min |
0 |
10 |
20 |
30 |
40 |
50 |
c(H2O2)/mol•L﹣1 |
0.70 |
0.49 |
0.35 |
0.25 |
0.17 |
0.12 |
0~30 min H2O2反应的平均速率v= mol•L•min﹣1
(5)H2O2 的一种衍生物K2S2O8,阴离子结构式为(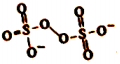 )。其中性溶液加热至沸后,溶液pH降低,用离子方程式表明原因: 。
)。其中性溶液加热至沸后,溶液pH降低,用离子方程式表明原因: 。
以黄铁矿(主要成分FeS 2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如图所示。

回答下列问题:
(1)黄铁矿中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为 。
(3)欲得到更纯的NaHSO 3,反应①应通入 (填"过量"或"不足量")的SO 2气体。
(4)因为Na 2S 2O 5具有 性,导致商品Na 2S 2O 5中不可避免地存在Na 2SO 4。检验其中含有SO 4 2 ﹣的方法是 。
(5)一般用 K 2Cr 2O 7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K 2Cr 2O 7溶液滴定其中的Fe 2+。
反应式:Cr 2O 7 2 ﹣+6Fe 2++14H +═2Cr 3++6Fe 3++7H 2O
某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol•L ﹣ 1的K 2Cr 2O 7溶液25.10mL,则样品中铁含量为 %。
氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为,反应中消耗1mol的MnO4—时转移电子数为。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是,又变为棕黄色的原因是。
试题篮
()