 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是 
| A.KClO3在反应中失去电子 | B.ClO2是氧化产物 |
C.H2C2O4在反应中被氧化 | D.1mol KClO3参加反应有2 mol电子转移 |
 氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的生成物是
氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的生成物是
| A.HI和HClO | B.HCl和HIO | C.HClO3和HIO | D.HClO和HIO |
(8分)甲、乙两池的电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式________________________________________。
②甲池中炭极上的电极反应式是________,乙池中炭极上的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池炭极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为5 ∶1,且生成两种酸,该反应的化学方程式为
________________________________________________________________________。
④若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,则溶液混匀后的pH=________。
(8分)(2011·济南一模)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
(8分)单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多1,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀,各物质间的转化关系如图所示(反应条件多数已略去):
请回答:
(1)反应⑥的离子方程式是_______________________________________________。
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________。
(3)在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是_______________________________________________
________________________________________________________________________。
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是________________________________________________________
________________________________________________________________________。
(5)反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式________________________________________________________________________。
(8分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
________________________________________________________________________
________________________________________________________________________。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式
________________________________________________________________________。
(3)如图是101 kPa时氢气在氯气中点燃生成氯化氢气体的能量变化示意图:
写出此反应的热化学方程式_________________________________________________。
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式________________________________________________________________________。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干,焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小,用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_____________ ___ ________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是________________ ________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________ _______;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____ ___(填字母代号)。
(4)滴定终点的现象是______________________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为________________.
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”).
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果________。
工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
(1)聚合物F的结构简式是 ;
(2)D转化为E的化学方程式是 ;A转化为B的反应类型是 。
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是 。
(4)写出3种含有一个羟基、一个酯基的E的同分异构体的结构简式:
、 、 。
1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g)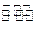 Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为 。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2)=c(H2O) d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡: ②加入少量灼热的碳粉,则平衡:__
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性___ _,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是 。
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3SO4的致密的保护层——“发蓝”。主要反应如①②③:
①3Fe+NaNO2+5NaOH→3NaFeO2+NH3+H2O
②___Na2FeO2+____NaNO2+____H2O→ Na2Fe2O4+ NH3+ NaOH
③Na2FeO2+Na2Fe2O4+2H2O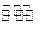 Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②,标出电子转移方向和数目。
(2)上述反应②中还原剂为 ,被还原物质是____ 。
若有1mol Na2Fe2O4生成,则反应中有____mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是: 。
(15分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系:(无机物略去)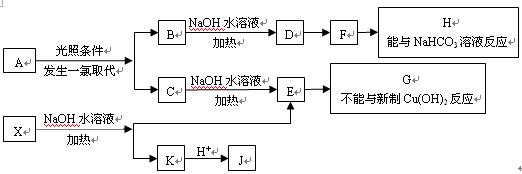
 (1)①A物质的名称为:______。(2分) ②X E+K的反应类型是______。(2分)
(1)①A物质的名称为:______。(2分) ②X E+K的反应类型是______。(2分)
(2)G、F中所含的含氧官能团的名称分别为___________、___________。(各1分)
(3)E与H反应的化学方程式是________________________________;(2分)
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,
B→I的化学方程式________________________________________;(2分)
(5)已知J有多种同分异构体,符合下列性质的J的同分异构体共有_____种。(3分)
①与FeCl3溶液作用显紫色; ②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种。写出其中一种一氯代物的结构简式____________(2分)
请回答
(1)若甲、乙、X均是化合物,Y是单质,则Y可能是 。(填化学式,下同)
(2)若酸性X>Y,且甲过量,Y是白色浑浊,则Y是 乙是 (各1分)
(3)若甲、乙是金属单质,X为固体,则反应的化学方程式是
(4)甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y是化合物。X溶液呈淡绿色,Y的溶液能使KSCN溶液变红。
①将Y的饱和溶液滴入沸水中,继续加热可得红褐色液体丙,证明丙的操作、现象及结论
是 (3分)
②单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为: (用化学式表示)
③当X与甲1:1充分反应的离子方程式: (2分)
[化学——-选修5:有机化学基础]有机物A为芳香烃类化合物,质谱分析表明其相对分子质量为104,分子中含有碳碳双键,F为有香味的有机化合物,G是一种能制成塑料的高分子化合物,其相关反应如下图所示:
(1)D中所含官能团为_______。
(2)II的反应类型为 _______ ,G的结构简式为_______。
(3)写出下列反应的化学方程式: I:_______ ;V;_______。
(4)若A分子中的一个H原子在一定条件下被Cl原子取代,互为顺反异构体,它们的结构简式为_______。
(5)E有多种同分异构体,其中含有 结构,且苯环上含有两个取代基的有____种,其中在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:_______
结构,且苯环上含有两个取代基的有____种,其中在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:_______
[化学——选修3:物质结构与性质]W、Q、R、X、Y、Z六种元素的原子序数逐渐增大。已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为msnMpn。请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是_______,该分子中含有____个 键。
键。
(2)Z原子的核外电子排布式为_______;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为_______。
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于____晶体;Q、R、X三种元素的第一电离能数值由小到大的顺序为_______(用元素符号回答)。
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。
该晶体中阳离子和阴离子个数比为____,晶体中每个Xn-被_______ 个等距离的C+离子包围。
【化学——选修2:化学与技术】
KMnO4是一种常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产。即在反应器中碱性条件下用氧气氧化KnO2得到K2MnO4,分离后得到K2MnO4,再在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
回答下列问题:
(1)写出反应器中反应的方程式_______
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量较低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏离,用离子方程式表示KOH消耗偏高的原因____。
(3)写出电解槽中阴极和阳极的电极反应方程式阴极:_______ :阳极:____。
(4)在传统工艺中,得到K2MnO4后,向其溶液中避入CO2制备KMnO4,配平方程式:
K2MnO4+_______CO2=" _______KMnO4+_______ " MnO2+ _______K2CO3
将所得到的KMnO4配成0.1mol·L-1KMnO4溶液,滴定20.00 rnL未知浓度的FeCl2液,消耗KMnO4溶液30.00 mL。滴定达到终点时的现象为:_______ ,则FeCl2溶液的浓度为_______mol/L。
试题篮
()