将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
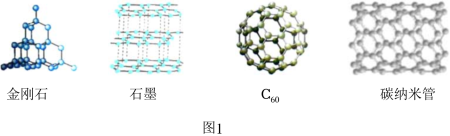
(1)图1所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
(2)酞菁和钴酞菁的分子结构如图2所示。
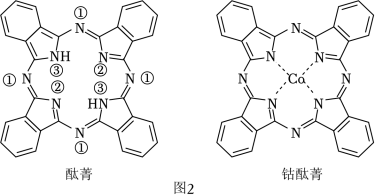
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是 (填图2酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为 ,氮原子提供孤对电子与钴离子形成 键。
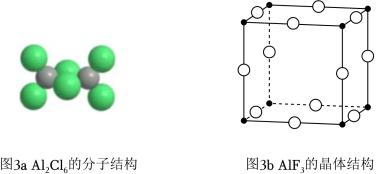
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图3a所示,二聚体中Al的轨道杂化类型为 。AlF3的熔点为1090℃,远高于AlCl3的192℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图3b所示,F﹣的配位数为 。若晶胞参数为apm,晶体密度ρ= g•cm﹣3(列出计算式,阿伏加德罗常数的值为NA)。
铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为( ,还含有一定量的 和 )生产 的一种工艺流程如图。
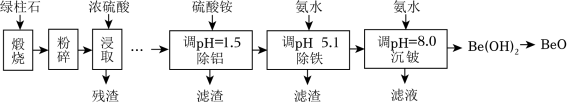
回答问题:
(1) 中 的化合价为_____。
(2)粉碎的目的是__________;残渣主要成分是_____(填化学式)。
(3)该流程中能循环使用的物质是_____(填化学式)。
(4)无水 可用作聚合反应的催化剂。 与足量 在 制备 的化学方程式为__________。
(5)沉铍时,将 从 提高到 ,则铍的损失降低至原来的_____ 。
在2FeS04+ H202 +H2S04=Fe2(S04)3+2H20反应中,氧化剂是 ,还原剂是__ __;被氧化的元素是 ,被还原的元素是 。反应中若转移了0.3mol e,消耗H2 02物质的量为 。
下列四个装置图均与电化学有关,请根据图示回答相关问题:
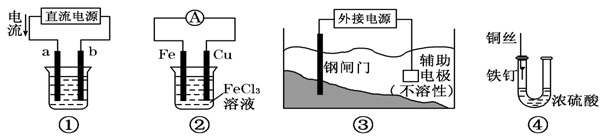
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
2015年某市决定开工建设垃圾焚烧发电厂,以改善目前填埋方式处理垃圾对环境产生的不良影响。其建成后既能利用垃圾,也能利用前期填埋垃圾产生的沼气,作为焚烧的原料。
(1)认为这样做的好处是 。(至少答两点)
(2)前期填埋的垃圾中易腐败的有机物在一定条件下被细菌分解为沼气,沼气的成分是__________(填名称)。写出沼气燃烧的化学方程式: 。
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装上“催化转换器”(用钯、铂合金作催化剂)。它的特点是使 CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式____________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度。其原因是___________________。
(3)控制城市污染源的方法可以有___________________。
我国北方春天在播种时,种子下地后往往在土壤上面覆盖上塑料薄膜,其主要作用是 ,体现了塑料薄膜具有 性质。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
(2)Z元素位于元素周期表________区,目前该元素发现________种同位素;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是__________;
(5)X的氢化物与同族第二、第三周期元素所形成的氢化物沸点由高到低顺序是(用化学式表示)______.
回答下问题:
(1)C、N、O三种元素的第一电离能由大到小的顺序是__________________。
(2)C、Si、N的电负性由大到小的顺序是__________________。
(3)氟化氢水溶液中存在的氢键有_________种。
(4)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,Ni的基态原子有________种能量不同的电子。很多不饱和有机物在Ni催化下可以H2发生加成反应。如①CH2=CH2、②HC≡CH、③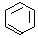 、④HCHO,其中碳原子采取sp2杂化的分子有__________(填物质编号),HCHO分子的立体构型为______________。
、④HCHO,其中碳原子采取sp2杂化的分子有__________(填物质编号),HCHO分子的立体构型为______________。
(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。

(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式: 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的正极电极反应式是__________________。
(4)利用右图装置可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。
假设海水中只有NaCl溶质,写出此时总离子反应方程式:
②若X为锌,开关K置于M处,该电化学防护法称为 。写出铁电极处的电极反应式:____________。
下图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:

(1)若试管内液面上升,则铁钉发生了 腐蚀,
正极反应式为 。
(2)若试管内的液面下降,则铁钉发生了 腐蚀,
负极反应式为 ,正极反应式为 。
已知:2SO2 (g) + O2 ═ 2SO3 (g) △H = ﹣196.6kJ•mol﹣1 , 2NO (g) + O2 ═ 2 NO2(g) △H = ﹣ 113.0kJ•mol﹣1.则反应 NO2 (g) + SO2 (g) ═ SO3 (g) + NO (g) 的 △H= .
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
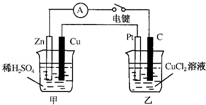
(1)甲装置的名称是 ;乙装置的名称是 ;Zn为 极;Pt为 极.
(2)写出电极反应式:Cu极 ;C极 .
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色 (填“变深”、“变浅”或“无变化”).
(4)若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将 (填“增大”、“减小”或“不变”,下同);乙中溶液的pH将 .
(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出热量649.5 中kJ,则表示乙硼烷燃烧热的热化学方程为 .
又已知:H2O(l)═H2O(g);△H=+44.0kJ/mol.则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量为 .
(2)恒温、恒压(1.01×105Pa)下,将2.0molSO2与amolO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g);△H<0,T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a= .
化学与人们生活质量的提高以及社会发展有着密切的关系.
(1)①保护环境已经成为全人类的共识.下列物质会破坏臭氧层的是 (填字母).
a.二氧化碳 b.二氧化硫 c.氮氧化物
②工业上制造水泥、玻璃和高炉炼铁都要用到的原料是 (填字母).
a.纯碱 b.石灰石 c.黏土
③光导纤维的主要成分是 (填化学式).
(2)泡沫铝是一种新型材料,它是在熔融的铝合金中加入发泡剂制成的,其优点是硬度高,密度小,比木材还轻,可浮于水面,又有很大的刚性,且隔音、保温,是一种良好的建筑材料和轻质材料.
①下列关于泡沫铝的说法错误的是 (填字母).
a.是纯净物 b.可用来制造飞机 c.可用作隔热材料
②铝元素在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制.铝及其化合物在下列场合使用时必须加以控制的是 (填字母).
a.制电线电缆 b.用明矾净水 c.制防锈油漆
③铝在空气中能表现出良好的抗腐蚀性,是因为它与空气中的氧气反应生成 并牢固地覆盖在铝表面,阻止了内部的铝与空气接触,从而防止铝被进一步氧化.
(3)如图为实验室中盐酸试剂瓶标签上的部分内容.试回答下列问题:

①下列有关浓盐酸的说法中正确的是 (填字母).
a.属于含氧酸 b.和氯化氢的性质相同 c.很容易挥发
②该盐酸的c(HCl)为 L mol/L.
③欲用该盐酸配制1.19mol/L的盐酸480mL.请完成下列有关操作中的空白:
a.用量筒准确量取该盐酸 mL,注入烧杯中,加入适量的水,混合均匀;
b.将操作a所得的盐酸沿玻璃棒注入 mL容量瓶中;
c.用适量的水洗涤烧杯、玻璃棒2~3次,洗涤液均注入容量瓶中,振荡;
d.缓缓地将蒸馏水注入容量瓶中,直到瓶中的液面接近容量瓶的刻度线l~2cm处,改用 加蒸馏水至溶液的凹液面正好与刻度线相切;
e.将容量瓶盖好,反复上下颠倒摇匀.
试题篮
()