世界环保联盟建议全面禁止使用氯气对饮用水进行消毒,而建议采用高效“绿色‘消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体、易溶于水,不稳定,呈黄绿色。在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备二氧化氯的流程如图:
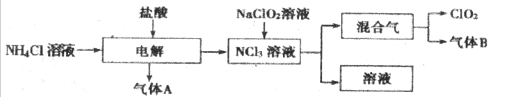
(1)二氧化氯中所有原子 (填“是”“不是”)都满足8电子结构。如图所示,用电解法制得的产物中,杂质气体B能是石蕊试液显蓝色,除去杂质气体可选用 (填序号)。
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是 (填序号)。
A.二氧化氯克广泛用于工业和饮用水处理
B.二氧化氯的消毒效率比氯气的消毒效率高
C.稳定性二氧化氯的出现大大增加了二氧化硫的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用铝酸钠氧化浓盐酸制备二氧化氯。化学反应方程式为 。缺点主要是产率低,产品难以分离。还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备二氧化氯,化学方程式为 。此法相比欧洲方法的优点是 。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的操作(H2C2O4)溶液还原铝酸钠,化学反应方程式为 。此法提高了生产及储存、运输的安全性,原因是 。
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出反应的离子方程式:_____________ 。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式: FeSO4+ K2O2 → K2FeO4+ K2O+ K2SO4+ O2↑,当转移了1.5NA个电子时,在标况下可收集到 升氧气。
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,高铁酸钾作为水处理剂发挥的作用是______________________ 。
脱水偶联反应是一种新型的直接烷基化反应,例如:
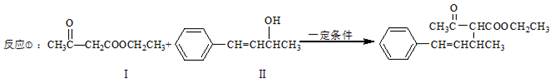
(1)化合物Ⅰ的分子式为_________,1mol该物质完全燃烧最少需要消耗___________molO2。
(2)化合物Ⅱ可使__________溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11C1)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为____ __。
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1:1:1:2,Ⅳ的结构简式为___________。
(4)由CH3COOCH2CH3可合成化合物Ⅰ。化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ。Ⅴ的结构简式为__________,Ⅵ的结构简式为__________。
(5)一定条件下, 也可以发生类似反应①的反应,有机产物的结构简式为_________。
也可以发生类似反应①的反应,有机产物的结构简式为_________。
下表是元素周期表的一部分,针对表中元素,填写下列空白
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 三 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)比HCl、H2S更稳定的氢化物是:__________________
(2)P、N、Mg原子半径由小到大的顺序是:_____________________
(3)Cl—的离子结构示意图是:________________________
(4)最高价氧化物对应水化物酸性最强的是:____________ (填名称)。:
(5)形成化合物种类最多的元素是:____________
(6)Si的最高价氧化物对应的水化物的化学式为:__________________
(7)Na与CuSO4溶液反应的化学方程式为(分步写): ;
。
[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元素 |
相关信息 |
| T |
T元素可形成自然界硬度最大的单质 |
| W |
W与T同周期,核外有一个未成对电子 |
| X |
X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y |
常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z |
Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是

A.O2是氧化剂
B.HO2 是氧化产物
C.HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3。
(1)已知H3BO3的电离常数为5.8×10﹣10,H2CO3的电离常数为Ka1=4.4×10﹣7、Ka2=4.7×10﹣11。向盛有饱和硼酸溶液的试管中,滴加0.1mol/L Na2CO3溶液, (填“能”或“不能”)观察到气泡逸出。
(2)已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH﹣=B(OH)4﹣,写出硼酸的电离方程式 ,它是 元酸。(填“一”或“二”或“三”)
(3)硼酸和甲醇在浓硫酸存在下生成B(OCH3)3,B(OCH3)3可与NaH反应制得易溶于水的强还原剂硼氢化钠(NaBH4)。①NaBH4中氢元素的化合价为 ,写出生成NaBH4的化学方程式 。
②写出生成B(OCH3)3的化学方程式 。
③用NaBH4和过氧化氢可以设计成一种新型碱性电池。该电池放电时,每摩尔NaBH4释放8mole﹣。写出这种电池放电反应的离子方程式 。
(4)H3BO3可以通过电解的方法制备。工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。

①写出阳极的电极反应式 。
②分析产品室可得到H3BO3的原因 。
(5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水。 实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为 。

“低碳循环”引起了全世界的高度重视,减排CO2的一种方法是:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
(1)500℃时有容积为2L的密闭容器中充入2mol CO2和6mol H2,测得CO2和CH3OH的物质的量随时间变化如图所示。

①反应的ΔS (填“>”或“<”)0,从反应开始到平衡,H2的平均反应速率:
υ(H2)=__________mol/(L·s)。
②该反应的平衡常数K=__________(保留二位有效数字);平衡时H2的转化率为________。
③将上述平衡体系的温度升高至700℃,平衡常数K=5.01,则ΔH 0(填“>”或“<”或“﹦”);为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有 __________(填序号)。
a.升高温度 b.缩小容器的容积 c.使用合适的催化剂 d.再充入CO2气体
(2)已知:①H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1257.5 kJ·mol-1
写出液态甲醇不完全燃烧生成CO气体和液态H2O的热化学方程式:
硼及其化合物在现代工业、生活和国防中有着重要的应用价值。

(1)基态硼原子的电子排布式是 ;最简单的硼烷是B2H6(乙硼烷),结构如右图所示,其中B原子的杂化方式为 ;
(2)三氯化硼和三氟化硼常温下都是气体,都有强烈的接受孤电子对的倾向。推测它们固态时的晶体类型为 ;三氟化硼与氨气相遇,立即生成白色固体,写出该白色固体结构式,并标注出其中的配位键 ;
(3)经结构研究证明,硼酸晶体中B(OH)3单元结构如图Ⅰ所示。各单元中的氧原子通过O﹣H…O氢键连结成层状结构,其片层结构及键长、层间距数据如图Ⅱ所示。层与层之间以微弱的分子间力相结合构成整个硼酸晶体。

①H3BO3是一元弱酸,写出它与水反应的化学方程式 ;
②根据结构判断下列说法正确的是 ;
a.硼酸晶体有滑腻感,可作润滑剂 b.H3BO3分子的稳定性与氢键有关
c.含1mol H3BO3的晶体中有3mol氢键 d.H3BO3分子中硼原子最外层为8e-稳定结构
(4)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,右图为其晶胞结构示意图。

①该功能陶瓷的化学式为 ;
②第一电离能介于B、N之间的第二周期元素有 种。
(除标注外,每空2分,共8分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是__ __。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是__ _。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
____。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值。涉及反应如下(均未配平):
NiOOH+Fe2++H+——Ni2++Fe3++H2O
Fe2++MnO +H+——Fe3++Mn2++H2O
+H+——Fe3++Mn2++H2O
则x=____;y=__。
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH = -49.0kJ·mol-1,
2CH3OH(g) =CH3OCH3(g)+ H2O(g) ΔH =-23.5kJ·mol-1,
则CO2与H2反应合成二甲醚的热化学方程式为 。
(2)若反应2CH3OH(g)  CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
| 物质 |
CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
| 浓度(mol·L-1) |
0.44 |
0.60 |
0.60 |
①写出该反应的平衡常数表达式:K= 。
②比较该时刻正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)
③若加入甲醇后经 10 min 反应达到平衡,则平衡后c(CH3OH)= ,该时间内反应速率v(CH3OCH3)= 。
(3)工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO、2 mol H2 |
1 mol CH3OH |
2 mol CO、4 mol H2 |
| CH3OH的浓度(mol/L) |
c1=0.25 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
①下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是 。
A. v正(H2)= 2v逆(CH3OH) B. n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2 : 1
C. 混合气体的密度不变 D. 混合气体的平均相对分子质量不变
E. 容器的压强不变
②下列说法正确的是 。
A. c1= c2 B. Q1= Q2 C. K1= K2 D. α2+α3 < 100%
③如图表示该反应的反应速率v和时间t的关系图:

各阶段的平衡常数如下表所示:
| t2~t3 |
t4~t5 |
t5~t6 |
t7~t8 |
| K4 |
K5 |
K6 |
K7 |
K4、K5、K6、K7之间的关系为 (填“>”、“<”或“=”)。反应物的转化率最大的一段时间是 。
铜、铁及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应(已知1 molCu2S失去10mol的电子),写出该反应的离子方程式 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)="2" mol·L—1,c(H2SO4)="4" mol·L—1的废酸混合液100 mL(不含其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为 。
(3)现有一块含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。(已知:金属生锈率= )
)
①上述铜片中铜的生锈率为 (结果保留2位有效数字)
②固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式 。

(4)高铁酸盐在能源环保等领域有广泛用途,如高铁酸钾(K2FeO4) 因有强氧化性,能杀菌消毒,产生Fe(OH)3有吸附性,是一种新型净水剂,用如下图所示的装置可以制取少量的高铁酸钾。
(已知爱迪生蓄电池的反应式为: )
)

①爱迪生蓄电池的负极材料是
②写出制取高铁酸钾阳极的电极反应式
③当生成19.8g的K2FeO4时,隔膜两侧电解液的质量变化差(△m右一△m左)为_ g。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0[ |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_______________ _。
(2)写出NaClO3发生反应的主要离子方程式________________ ___;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______ __。
(3)“加Na2CO3调pH至a ( a="6" )”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是______ ___、_______ ___和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是____________ __。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取 剂的目的是___ ___;其使用的最佳pH范围是___________。
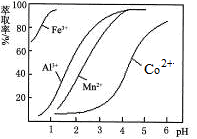
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 。
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:

①净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
②在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度 ;体系中要通入适量的氢气是为了 。
③X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)工业上可以通过如下图所示的流程制取纯硅:

①整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应,写出该反应的化学方程式 。
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
碱式碳酸铜[CuCO3·Cu(OH)2]是一种用途广泛的化工原料,可用于作有机催化剂、颜料制造、原油贮存时脱碱等。用废杂铜(主要成分为Cu,还含有少量杂质Fe)制取碱式碳酸铜的工艺流程如图所示。
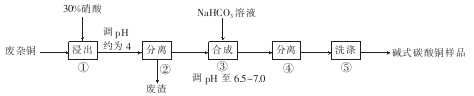
(1)步骤①浸出时,硝酸浓度不易过大,其原因是____。
(2)步骤②分离前需将溶液pH调节在4左右,其目的是 ,所得废渣的主要成分为____________。
(3)步骤③合成时,采用将NaHCO3溶液迅速投入Cu(NO3)2溶液中,其主要原因是 ;合成时发生反应的化学方程式为____________。
(4)本实验中两次用到固液分离,本实验中最适合固液分离的设备是____________。
(5)步骤⑤洗涤主要除去的杂质离子是 。
(6)准确称取所得产品m g,放入碘量瓶中,加入2 g KI及5 ml3 mol/L稀硫酸(两试剂均过量)摇匀并静置10 min(2Cu2++4I-=2CuI↓+I2),再加入2 mL淀粉溶液,用c mol/L的Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),到滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜元素的质量分数为________。
锰的化合物是优良的催化剂,可用于干电池原料生产等。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl ="2" MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为____。
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为 (填化学式)。[已知Ksp(MnS)=1.4×10-1 5,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3) Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:
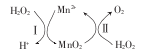
①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+( aq)=Mn2+(aq) +O2(g)+2H2O(1) △H2。写出反应I的热化学方程式(焓变用△H1和△H2表示): 。
②某温度时,向10 mL0.4 mol.L-1 H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:

0~2 min时反应速率比2~4 min时的快,其原因是_________;
0~6 min的平均反应速率v(H2O2)= (忽略溶液体积的变化)。
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:

①反应I的正反应是 (填“放热”或“吸热”)反应。
②反应Ⅱ的平衡常数表达式为 。
试题篮
()