现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738 kJ·mol-1 I2=1451 kJ·mol-1 I3=7733 kJ·mol-1 I4=10540 kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:______________________________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有__________个方向,原子轨道呈_______形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 该同学所画的电子排布图违背___________________。
该同学所画的电子排布图违背___________________。
(4)G位于________族________区,该元素的核外电子排布式为_________________。
(5)DE3中心原子的杂化方式为____________,用价层电子对互斥理论推测其空间构型为__________。
(6)检验F元素的方法是____________,请用原子结构的知识解释产生此现象的原因:_____________。
Ⅰ.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
(1)推断B元素在元素周期表中的位置_______________________。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为_____________。
(3)用电子式表示化合物E2F的形成过程_______________________。
(4)下图为某新型发电装置示意图,其负极电极反应为_______________________。

(5)在101kPa、25℃下,16g液态C2A4在D2中完全燃烧生成气体C2,放出312kJ热量,则C2A4和D2反应的热化学方程式为_______________________。
Ⅱ.A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。
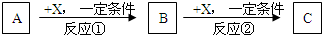
试回答:
(1)若X是强氧化性单质,则A不可能是___________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的 化 学式为___________。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为___________。
[化学—选修 有机化学基础]
现有分子式为CnH8O2X2的物质M,可发生如下所示转化:
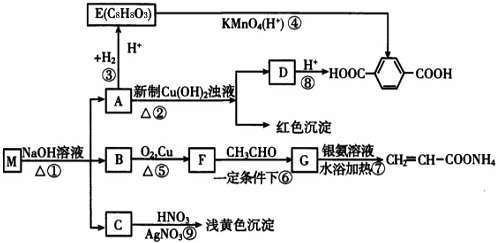
已知:①物质B在质谱分析中,在质谱图显示存在多种质荷比不相同的粒子,其中质荷比最大的为32,物质B在核磁共振氢谱分析中,有两个吸收峰,吸收峰面积之比为3:1。
②两个-OH同时连在一个C原子上,结构不稳定,会自动失水,如:
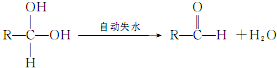
请回答下列问题:(1)n值为_______,M中官能团名称为__________。
(2)①、③的反应类型:①_______,③__________。
(3)写出M、E、G的结构简式;M:_______;G:_______。
(4)写出下列反应的化学方程式:A→D:__________。
(5)符合下列条件的E的同分异构体有_______种,写出其中核磁共振氢谱有五组峰,峰面积之比为1:1:2:2:2的同分异构体的结构简式为__________________(写一种)。
①能发生水解反应 ②能发生银镜反应 ③遇FeCl3溶液显紫色
A、B、D、R、Q五种短周期主族元素,其原子序数依次增大,其中A原子核内无中子,B与D同周期,R与Q同周期,A与R同主族,D与Q同主族,D元素的原子最外层电子数是次外层电子数的三倍,B元素的最高正价和最低负价代数和为2。请用对应的化学用语回答下列问题:
(1)Q元素位于元素周期表中第______周期_____族。
(2)D、R、Q三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(3)由A、B两种元素以原子个数比为5:1形成的离子化合物X,X的电子式为_______。
(4)由A、B元素形成的A2B4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为____。
(5)由A、D、R、Q四种元素形成的化合物Y(RAQD3)(已知A2QD3的Ka1=1.2×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为_______________;室温下,向Y溶液中加入一定量的NaOH,使溶液中c(AQD3-)=c(QD32-),则此时溶液呈______(填“酸性”、“碱性”或“中性”)
(6)Fe与D元素可形成Fe2D3、Fe3D4等化合物。向5.2g Fe2D3、Fe3D4、Cu的混合中加入0.5mol/L的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为______g。
已知:相同的两种元素组成的四种微粒A、B、C、D的质子数依次增多, A、B、C、D的电子数如表(A、B、C、D有两组可能),且D中的电子数等于质子数,D1可作医用消毒液。 其中B1的沸点比B2高。
| ① |
A1 |
B1 |
C1 |
D1 |
| 电子数 |
10 |
10 |
10 |
18 |
| ② |
A2 |
B2 |
C2 |
D2 |
| 电子数 |
10 |
10 |
10 |
18 |
试回答下列问题:
(1)上述两组八种微粒的组成元素中,原子序数处在中间的元素在元素周期表的位置是 ; D1的电子式为: 。
(2)液态的B2与Na反应的方程式: 。
(3)①亚氯酸钠(NaClO2)主要可用于棉纺、造纸业做漂白剂,也用于食品消毒、水处理等,制备亚氯酸钠,可以将ClO2气体通入D1和NaOH的混合液中,请写出制备方程式 ,其中D1的作用是 ;
②利用①中原理制备出NaClO2•3H2O晶体的试样,可以用“间接碘量法”测定试样(不含能与I―发生反应的氧化性杂质)的纯度,过程如下(已知:I2 + 2S2O32ˉ = S4O62ˉ + 2Iˉ):

步骤一的离子方程式为_______;步骤二的指示剂是______;步骤三中出现________现象时,达到滴定终点;计算该试样中NaClO2•3H2O的质量百分数为_______。
现有下列11种中学化学常见的物质,在一定条件下可以实现如图所示的转化关系,图中某些反应物和生成物已经略去。

已知:A为两种元素组成的化合物,其焰色反应透过蓝色钴玻璃观察到为紫色;B为单质,是一种有毒气体;反应①的条件是用惰性电极电解;反应②的条件是将E的水溶液加热蒸干、灼烧;Y为常见金属;F中金属元素(+3价)质量分数为70%,C为三核22电子的氧化物。
回答下列问题:
(1)D的电子式为____,H的化学式为 。
(2)反应③的化学方程式为 。过量C通入I溶液中发生反应的离子方程式为 。
(3)指出G的一种用途: 。
(4)将一定量的B通入到含有l mol XBr2的溶液中,若有1/3的Br一被氧化,则通入的B在标准状况下的体积为 L(保留一位小数)。
(5)有同学说:“根据类比推理,三价x的硫酸盐溶液加热蒸干后得到的固体跟物质E加热蒸干后得到的固体是相同的”,这个说法是否正确? (填“正确”或“不正确”),理由是 。
高分子材料N在光聚合物和显示材料方面有重要用途,其中间体M的合成途径如下:

(1)M的分子式为 __________ 。
(2)下列有关物质A的说法正确的有________(填序号)。
a.一定条件下最多可与1mol H2发生加成反应 b.能使Br2的CCl4溶液褪色
c.分子中含有一个π键 d.能使酸性KMnO4溶液褪色
(3)A中官能团的名称是________,由C→B反应类型为________。
(4)由A催化加氢生成M的过程中,可能有副产物 和________________(写结构简式)生成。
和________________(写结构简式)生成。
(5)检验B中是否含有C可选用的试剂是________(任写一种名称)。
(6)物质B也可由C10H13Cl与NaOH水溶液共热制得,C10H13Cl的结构简式为__________________。(7)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3
b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:__________________________。
A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,C的单质只有氧化性。
(1)写出实验室制取E2反应的离子方程式_______________________________;
(2)A、C元素按原子个数比为1:1形成化合物的电子式_________________;
(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.

①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)________;若装置D中装的是铁粉,当通入E2时D中观察到的现象为____________;若装置D中装的是五氧化二钒,当通入DC2时,打开K通入适量C2,化学反应方程式为________________________________。
②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转 移了5.0×10-5mol电子,则该反应的化学方程式为_______________________________。
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)_________,可以看到白色沉淀生成;
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式______________________________。
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①M的化学式为____________________________。
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为__________mol/L。
物质M是一种日常生活中不可缺少的调味品。已知C在D中燃烧发生苍白色火焰,M与其他物质的转化关系如图甲所示(部分产物已略去);
(1)写出用惰性电极电解M溶液的离子方程式___________________________________。
(2)比较B中各元素原子半径大小__________(填元素符号)。
(3)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是______________。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_______________________________。
(5)若A是一种溶液,只可能含有H+,NH4+,Mg2+,Fe3+,Al3+,CO32-,SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图乙所示.由此可知,该溶液中肯定含有的离子及其浓度之比为___________________________。
(6)若E可用于检验葡萄糖的存在,写出G溶液充分蒸发灼烧后的产物与乙醇反应的化学方程式________。
(7)根据右图,写出25℃时由CO2和H2O转化为葡萄糖溶液的化学方程式______________________。
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,Y2X2分子中σ键和π键个数比为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为 。
②W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于 (填晶体类型),该晶体中W的化合价为 。
(5)下列有关的说法正确的是 。
| A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
| B.电负性顺序:X<Y<Z<Q |
| C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 |
| D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸 |
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)

【化学一一选修5:有机化学基础】
A、B均为重要的有机化工原料。

已知:

请回答下列问题:
(1)A分子内含有苯环,其名称是 ,
(2)B的一种同分异构体能发生银镜反应,该反应的化学方程式是: ,
(3)A与B反应生成J的化学方程式是 ,
(4)K分子内含有六元环,可发生水解反应,其结构简式是 ,
(5)F和L反应生成G是加成反应,L的结构简式 ,
F的结构简式是 ,
(6)B分子中只有一种氢原子,2 mol B反应生成1 mol C的化学方程式是: ,
(7)D分子内有3个甲基,其结构简式是 。
有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:

已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为

请回答下列问题:
(1)根据系统命名法,B的名称为__________。
(2)官能团—X的名称为____________,高聚物E的链节为________。
(3)A的结构简式为______________。
(4)反应⑤的化学方程式为________________________________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式_______________。
Ⅰ.含有苯环 Ⅱ.能发生银镜反应 Ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是_________________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+) (填“=”、“>” “<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol•L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol•L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②室温时,0.1mol•L﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)= mol•L﹣1(填数值)
(3)室温时,向100mL 0.1mol•L﹣ 1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在c点,溶液中各离子[浓度由大到小的排列顺序是 。
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验

将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并 加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是 。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。
写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 工业上可利用CO生产乙醇:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)="==" H2O(g) ΔH2
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有 。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为__ (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.
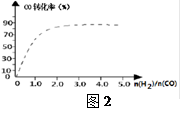
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________。
试题篮
()