将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如下图所示。则下列说法不正确的是
| A.生成的氢气在标准状况下的体积为11.2 L |
| B.最初20 mLNaOH溶液用于中和过量的硫酸 |
| C.硫酸的物质的量浓度为2.5 mol/L |
| D.镁和铝的总质量为9 g |
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下: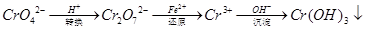
己知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是( )
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是( )
| A.转化过程中,增大c(H+),平衡向正反应方向移动,CrO42﹣的转化率提高 |
| B.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5 |
| C.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g |
| D.常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。某课外活动小组为确定反应后的废液组成,进行如下实验:(1)取100.00mL反应后的废液加入足量的AgNO3溶液,生成沉淀12.915g。(2)另取100.00mL反应后的废液加入过量铜片充分反应,铜片质量减少了0.32g。下列关于反应后的废液组成判断正确的是
| A.只含有Fe 2+、Cu2+、Clˉ,不含有Fe 3+ |
| B.c(Fe2+)︰c(Cu2+) = 1︰1 |
| C.c(Fe3+)︰c(Fe2+)= 1︰3 |
| D.c(Clˉ) ="0.9mol" / L,c(Fe 3+) =" 0.1mol" / L |
已知:①2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
②K2Cr2O7+14HCl→2KCl+2CrCl3+3Cl2↑+7H2O
③MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(大于6mol∙L-1)反应,MnO2需和浓盐酸反应(大于8mol∙L-1)反应。
根据以上信息,下列叙述不正确的是
| A.上述各反应均既属于氧化还原反应,有属于离子反应 |
| B.氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
| C.盐酸的浓度越大,Cl-的还原性越强 |
| D.每生成1molCl2,上述各反应转移的电子数均为2NA(NA为阿伏加德罗常数的值) |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是()
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.反应最后形成的溶液中含有的溶质只有Na2SO4 |
室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随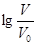 的变化如图所示。下列叙述正确的是()
的变化如图所示。下列叙述正确的是()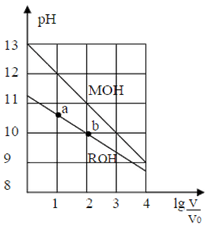
| A.稀释前两溶液的Ka:MOH溶液>ROH溶液 |
| B.ROH的电离程度:b点小于a点 |
| C.两溶液在稀释过程中,c(H+)均逐渐减少 |
D.当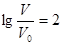 时,若两溶液同时升高温度,则 时,若两溶液同时升高温度,则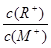 增大 增大 |
将一定质量的铜粉加入到100 mL某浓度的稀硝酸中,充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体560 mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉m2 g,则(m1-m2)为
| A.7.2 | B.2.4 |
| C.0 | D.缺少条件,无法计算 |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol·mol-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是()
| A.60mL | B.45mL | C.30mL | D.75mL |
将9.58 g Na2CO3·10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)="1" mol/L。再取同质量的混合物,加入足量的盐酸 ,充分加热蒸干至质量不变时,所得固体的质量为: ()
| A.5.30g | B.7.78g | C.6.72g | D.6g |
在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生:CO(g)+2H2(g) CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是
CH3OH(g)△H。测得平衡时CO的转化率随温度及不同压强下的变化。P2和195℃时n(H2)随时间的变化结果如表格所示。下列说法正确的是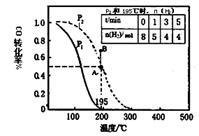
| A.0~3 min,平均速率v(CH3OH)="0.8" mol•L-1•min-1 |
| B.P1<P2,△H<0 |
| C.在P2及195℃时,该反应的平衡常数为25 |
| D.在B点时,v(正)>v(逆) |
将2.32 g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中缓慢逐滴加入浓度为 0.1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是()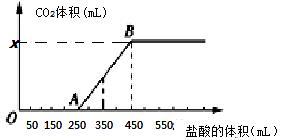
| A.OA段发生反应的离子方程式为:H++OH-===H2O CO+H+===HCO |
| B.当加入350 mL盐酸时,产生CO2的体积为224 mL(标准状况) |
| C.x点对应的数值是448 |
| D.混合物中NaOH的质量为1克 |
将一定量的Cl2通入体积为40mL、浓度为7.5 mol/L的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO物质的量0.03mol,下列说法不正确的是()
| A.该反应的离子方程式为:5Cl2+10OH-=7Cl-+2ClO-+ClO3—+5H2O |
| B.该反应中,氧化剂与还原剂物质的量之比为5:3 |
| C.上述苛性钾溶液中含有0.3mol的KOH |
| D.反应后生成的ClO-和ClO3-两种离子在一定条件下均有氧化性 |
1,2,3-三苯基环丙烷的三个苯基可以分布在环丙烷环平面的上下,因此有如下两个异构体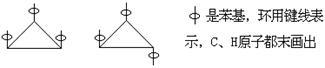
据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的同分异构体数目是()
| A.4 | B.5 | C.6 | D.7 |
常温下,在20 mL 0.1mol/L Na2CO3溶液中逐滴加入0.1 mol/L 盐酸40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。下列说法不正确的是()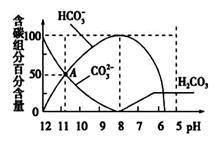
| A.0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B.在A点:c(Na+)> c(CO32-)> c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.当加入20 mL盐酸时,混合溶液的pH约为8 |
25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是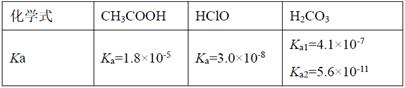
| A.相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) |
| B.在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 |
| C.等物质的量浓度的NaClO和NaHCO3混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO |
试题篮
()