已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如(下面左图):
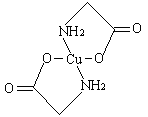
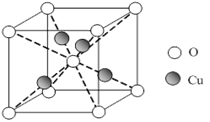
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)A中碳原子的轨道杂化类型分别为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如(上面右图),则该化合物的化学式是 。
(1)为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内。
| Ⅰ 除杂实验 |
Ⅱ 试剂 |
Ⅲ 操作方法 |
答案 |
||
| Ⅰ |
Ⅱ |
Ⅲ |
|||
| ①苯(苯酚) |
A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO |
a.蒸馏 b.分液 c.盐析、过滤 d.萃取 |
① |
|
|
| ②乙醇(水) |
② |
|
|
||
| ③肥皂(甘油、水) |
③ |
|
|
||
| ④乙酸乙酯(乙酸) |
④ |
|
|
(2)如图均是由4个碳原子结合成的6种有机物(氢原子没有画出).
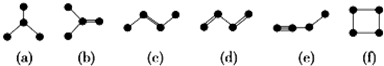
①有机物(a)有一种同分异构体,试写出其结构简式 .
②上述有机物中与(c)互为同分异构体的是 (填代号).
③任写一种与(e)互为同系物的有机物的结构简式 .
④(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有 (填代号).
(3)下列实验中,需要用水浴加热的是 ,
①新制Cu(OH)2与乙醛反应; ②银镜反应; ③溴乙烷的水解;
④乙酸和乙醇反应制乙酸乙酯;⑤由乙醇制乙烯;⑥苯的硝化
某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。

(1)稀硫酸应放在 中(填写仪器编号).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关 、打开开关 就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由 .
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是 .
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是 。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗高锰酸钾溶液体积/mL |
25.52 |
25.02 |
24.98 |
滴定过程中发生反应的离子方程式为 .
滴定终点的现象是 .
通过实验数据计算的该产品纯度为 (用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
湿法炼锌的冶炼过程可用如图简略表示:
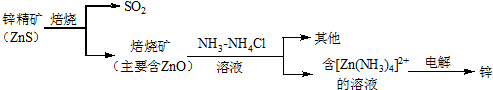
请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是 .
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为 .
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 .
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 .

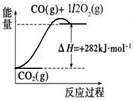
(6)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 ________(填写选项编号).
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 ________(填写选项编号).
A.高温、高压 B.高温、低压
C.低温、低压 D.低温、高压
(7)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0,恒温恒容密闭容器中,下列依据能说明该反应达到平衡状态的是 .
CO(NH2)2(l)+H2O(g) △H<0,恒温恒容密闭容器中,下列依据能说明该反应达到平衡状态的是 .
A、容器中气体密度不变
B、容器中气体压强不变
C、n(NH3):n(CO2)=1:2
D、单位时间内消耗1molCO2,同时消耗1molH2O
E、容器内温度保持不变
(8)某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,发生2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)反应,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________.上图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应从开始至平衡时的曲线。
CO(NH2)2(l)+H2O(g)反应,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________.上图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应从开始至平衡时的曲线。

有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:
① Cu2O + 2H+ =" Cu" + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
1.8 |
6.3 |
5.2 |
| 完全沉淀的pH |
3.0 |
8.3 |
6.7 |
注:金属离子的起始浓度为0.1 mol·L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是 ;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为 ;若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为
组合1: ;组合2: ;……(用化学式表示)
减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。

①M、N两点平衡状态下,容器中总物质的物质的
量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的
大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。
②电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+====5O2↑+2N2↑+2H2O,则阴极反应式为 。

SO2和NOx都是大气污染物。
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知:① N2(g)+O2(g)= 2NO(g)ΔH=+180.6 kJ·mol-1
②C(s)+O2(g)= CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g)= CO2(g)+N2(g)ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2,要找到适合的物质G与适当的反应条件,G应为
(填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。NO2+G N2+H2O+nX(未配平的反应式)。下列化合物中,满足上述反应式中的G是 (填写字母)。
N2+H2O+nX(未配平的反应式)。下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
(5)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。

①b极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为 。
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,
用原子结构的观点解释其原因是 。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度: BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀pH |
1.9 |
7.0 |
3.4 |
| 完全沉淀pH |
3.2 |
9.0 |
4.7 |
①Ⅰ中,反应的化学方程式是 。
②Ⅱ中,能与盐酸反应溶解的物质有 。
③Ⅳ的目的是 。
④下列关于该工艺流程的说法正确的是 。
a.该工艺产生的废液含较多的NH4+、Na+、Cl-、SO42-
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率
综合利用CO2对环境保护及能开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______。
a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是______。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
已知:

反应A的热化学方程式是_______。
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

① 电极b发生 (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是______。
(5)CO与H2在高温下合成C5H12(汽油的一种成分)减少碳排放。已知燃烧1 mol C5H12(g)生成H2O(g)放出约3540 kJ的热量。根据化学平衡原理,说明提高合成C5H12的产率可采取的措施是______。
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ. RCOOR’+ R’’18OH RCO18OR’’+R’OH(R、R’、R’’代表烃基)
RCO18OR’’+R’OH(R、R’、R’’代表烃基)
Ⅱ.  (R、R’代表烃基)
(R、R’代表烃基)
(1)①的反应类型是 。
(2)②的化学方程式为 。
(3)PMMA单体的官能团名称是 、 。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为 。
(5)G的结构简式为 。
(6)下列说法正确的是 (填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 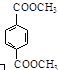 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是 。
(8)写出由PET单体制备PET聚酯并生成B的化学方程式 。
计算(将所得结果填在相应的空格内,共14分)
(1)在3L的密闭容器中充入2 mol A气体和2 mol B气体,在一定条件下发生反应:2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的0.8倍,则A的转化率为 。
2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的0.8倍,则A的转化率为 。
(2)某金属与足量稀硝酸充分反应,无气体放出,再向该溶液中加入过量NaOH溶液,加热,收集到标况下气体0.224升,整个过程转移电子的物质的量为 mol。
(3)在100 mL 混合溶液中,HNO3 和 H2SO4 的物质的量浓度分别是0.1 mol/L,0.4 mol/L向该混合液中加入 2.56g铜粉,加热待充分反应后,所得溶液中 Cu2+ 的物质的量浓度是 mol/L (假设溶液体积不变)。
(4)在1L2mol/L的AlCl3溶液中,加入1mol/L的NaOH溶液,产生了39g沉淀,则加入NaOH溶液的体积为 。
(5)钠、镁、铝均为0.2mol分别与 mL浓度为1mol/L的HCl溶液反应,产生氢气量相等。
(6)将32g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体标准状况下的体积为11.2L,气体全部逸出后,向溶液中加入VmL n mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为 mol/L。(结果须化简)
(7)已知1 g氢气完全燃烧生成水蒸气时放出热量a kJ,且氧气中1 mol O=O键完全断裂时吸收热量bkJ,水蒸气中1 mol H-O键形成时放出热量c kJ,则氢气中1 mol H-H键断裂时吸收热量为 kJ。
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32- (aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:

①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因 。
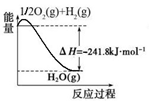
氢气是一种清洁能。用甲烷制取氢气的两步反应的能量变化如下图所示:

(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,随着温度升高该反应的化学平衡常数的变化趋势是 。
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是______(填序号)。
a. 四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b. 单位时间内断开amol H-H键的同时断开2a mol O-H键
c. 反应容器中放出的热量不再变化
d. 混合气体的密度不再发生变化
e. 混合气体的压强不再发生变化
(4)某温度下,第II步反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是 。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2O)/ mol/L |
0.010 |
0.020 |
0.020 |
| c(CO)/ mol/L |
0.010 |
0.010 |
0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D. 平衡时,乙中H2O的转化率大于25%
【化学----选修有机化学基础】合成肉桂酸异戊酯G(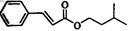 )的路线如下:
)的路线如下:

友情提示:
①B和C含有相同的官能团且C在标准状况下的气体密度为1.964g/L;
② 。
。
回答下列问题:
(1)A的结构简式为 ,D中含有的官能团的名称是 ;
(2)下列物质在一定条件下能与F反应的是 (填标号);
A.溴水 B.酸性KMnO4溶液
C.乙酸 D.新制氢氧化铜的悬浊液
(3)B和C反应生成D的化学方程式为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。(各2分)
(5)A的同分异构体中含有苯环的共有 种(不考虑立体异构且包括A),其中与氯化铁不能发生显色反应且核磁共振氢谱有四组峰,峰面积之比为3:2:2:1的为______ (写结构简式)。(各2分)
【化学——选修化学与技术】明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
 (1)在焙烧明矾的反应中,还原剂是 ;
(1)在焙烧明矾的反应中,还原剂是 ;
(2)从水浸后的滤液中得到K2SO4晶体的方法是 ;
(3)A12O3在一定条件下可制得AIN,其晶体结构如图所示,该晶体中Al的配位数是 ;

(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 ;
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是 ;
(6)焙烧948吨明矾(M=474g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸 吨。
试题篮
()