化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加 , 并不断振荡. |
有 产生. |
氢氧化钠溶液一定变质了. |
【提出问题2】该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
【查阅资料】
(1)氯化钙溶液呈中性.
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
【实验探究2】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的 溶液,并不断振荡. |
有 生成. |
说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. |
溶液变红色. |
说明原溶液中一定有 . |
【实验结论】该氢氧化钠溶液 (填“部分”或“全部”)变质.
【反思与评价】
(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式: .
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案 (填“可行”或“不可行”).
猪肉的新鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如下表所示。新鲜肉在变质过程中酸性强弱的变化为
| 名称 |
新鲜肉 |
次鲜肉 |
变质肉 |
| pH |
5.8~6.2 |
6.3~6.6 |
>6.7 |
A.变强 B.变弱 C.不变 D.无法确定
某化工厂排出的废水透明、澄清、略显蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀HNO3的白色沉淀生成。过滤,将所得滤液分成两份,一份滤液中加入少量稀H2SO4,也有不溶于稀HNO3的白色沉淀生成;另一份滤液中加入过量NaOH溶液,产生蓝色沉淀。试回答:
(1)用化学式回答:废水中加入过量的盐酸后,生成的白色沉淀是________________。
滤液中加入过量NaOH溶液后,生成的蓝色沉淀是_________________________。
(2)废水中一定含有的物质是__________________(填编号):
| A.氯化物 | B.硝酸盐 | C.硫酸盐 | D.碳酸盐 |
请简述你做出选择的理由__________________________________。
某化学小组初步探究"氢氧化钠溶液与盐酸发生中和反应时溶液温度的变化情况".
实验用品:37%的浓盐酸(密度为
)、10%的氢氧化钠溶液、蒸馏水、量筒、温度计
实验一:配制100
10%的盐酸(密度为
)
实验步骤
(1)计算:需要37%的浓盐酸的体积为
(精确到0.01
,下同);需要蒸馏水的体积为
(水的密度为
)
(2)量取浓盐酸和蒸馏水。
(3)混合配制。
实验二:在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸(室温下),反应中溶液温度的变化如下:

(1)表中
的值为.
(2)试绘出溶液温度变化与加入盐酸体积之间的关系图.
(3)根据所绘曲线分析,加入盐酸的体积在0~10
时,溶液温度变化的趋势及其原因是。
(4)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线的分析,大胆猜想新曲线最高点的位置(不考虑溶液密度和比热容的变化及热量散失等影响因素)。
横坐标及猜想理由:;
纵坐标及猜想理由:。

用初中所学知识分析化学反应 ,推论正确的是( )
| A. | 、 、 、 都只能是化合物 |
| B. | 15 和15 进反应,生成物 和 的质量总和一定是30 |
| C. | 如果 是一种酸,则 和 中一定有一种是盐 |
| D. | 如果生成物分别是盐和水,则反应物一定是酸和碱 |
下列做法不能达到目的的是()
| A. | 用加入洗涤剂的热水清洗餐具上的油污 |
| B. | 用过滤法除去粗盐中少量的可溶性钙、铁化合物 |
| C. | 用肥皂水区分硬水和软水 |
| D. | 用紫色石蕊溶液鉴别PH为3和PH为12的两瓶无标签溶液 |
"类推"是学习化学的常用方法,下列推理正确的是()
| A. | 酸和碱生成盐和水的反应属于中和反应,故盐酸和氢氧化钠溶液能发生中和反应 |
| B. | 酸的溶液pH<7,故pH<7的溶液一定是酸的溶液 |
| C. | 镁条在空气中燃烧生成白色固体,故铜片在空气中的灼烧也生成白色固体 |
| D. | 碳可用于炼铁,故碳可用于冶炼所有的金属 |
以科学原理和事实为依据进行推理是学习化学的一种重要方法,下列推理合理的是
| A. | 铵盐能与碱反应产生氨气,所以碳酸氢铵能与氢氧化钠反应产生氨气 |
| B. | 盐是由金属离子和酸根离子组成的,所以盐中一定含有金属离子 |
| C. | 有机物中一定含有碳元素,所以含有碳元素的化合物一定是有机物 |
| D. | 碱溶液能使无色酚酞试液变红,所以使无色酚酞试液变红的溶液一定是碱溶液 |
下列各组物质中,能相互反应且反应前后溶液总质量增加的是
| A. | 铁和硫酸铜溶液 | B. | 氧化铁固体和稀硫酸 |
| C. | 盐酸和澄清石灰水 | D. | 氯化钠溶液和硝酸钾溶液 |
将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示。
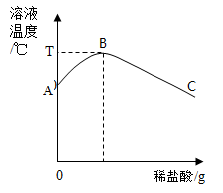
(1)在滴加的过程中,烧杯中溶液的
逐渐(填"增大"、"减小"或"不变")。
(2)由图可知,稀盐酸与氢氧化钠溶液发生的反应是(填"放热"或"吸热")反应。
(3)图中
点时,溶液中的溶质是(填化学式)。
下列应用和相应的化学方程式都正确的是
| A. | 高炉炼铁发生的主要反应: |
| B. | 用生石灰处理硫酸厂废液: |
| C. | 用稀盐酸除铁锈: |
| D. | 实验室用过氧化氢溶液制取氧气: |
向部分变质的氢氧化钠溶液中滴加过量稀盐酸,下列图像能正确反映对应变化关系的是
| A. |
|
B. |
|
C. |
|
D. |
|
某兴趣小组设计的趣味小实验装置如图所示。A、B是两个系在玻璃导管一端的气球,C是胶头滴管。经检验该装置气密性良好。若锥形瓶和胶头滴管中分别装入相应的试剂组合(假设药品均足量),充分振荡后,气球会发生相应的变化。
(请写出符合要求的试剂组合(仅写两种),但所用方案的原理不能重复!)
(1)若A球迅速膨胀而B球无明显变化,则锥形瓶与滴管中的试剂可能的组合是:① 、 ,② 、 。
(2)若B球迅速膨胀而A球无明显变化,则锥形瓶与滴管中的试剂可能的组合是:
① 、 ,② 、 。
已知:镁在空气中燃烧生成氧化镁和氮化镁(
),氮化镁与水反应生成氢氧化镁和氨气。
(1)写出氮化镁与水反应的化学方程式 ;
(2)a 克镁在空气中完全燃烧生成固体的总质量m为;(用含a 的式子表示m 的取值范围)
(3)某学生对该混合物中氮化镁的质量分数进行测定,设计如下实验装置
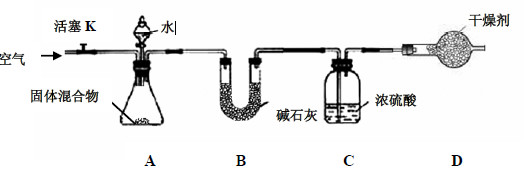
【查阅资料】
I.碱石灰是固体氧化钙和氢氧化钠的混合物,常用作干燥剂,不与
反应。
II.
III.
是一种极易溶于水的气体。
【实验步骤】①检查装置的气密性;②精确称量镁在空气中燃烧后的固体5.00g 放入锥形
瓶中,称量装置C,连接好装置;③关闭活塞K,打开A 中分液漏斗活塞,逐滴加入水,
至样品恰好完全反应;④打开活塞K,鼓入空气;⑤再次称量装置C,装置C 增重0.34g。
请回答:
(一)装置B 的作用是;
(二)装置D 的作用是;
(三)实验步骤④中鼓入空气的目的是;
(四)固体混合物中
的质量分数为;
(五)实验证明此方法测定的结果偏低,可能原因是(写一条)
将0.4%的氢氧化钠溶液滴加到2
0.4%的盐酸中,测得混合液的
变化曲线如图。某学习小组对加入0-
氢氧化钠过程中,所得混合液
增大原因进行了如下探究:

【猜想假设】
猜想Ⅰ:
增大是因为;
猜想Ⅱ:
增大是因为发生了反应,写出反应方程式。
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验。(可供选择的实验用品有:
计、0.4%的氢氧化钠溶液、0.4%的盐酸、水。)
(1)向2
0.4%的盐酸中加入
0.4%的氢氧化钠溶液,用pH计测得混合液的
=7。
(2)向2
0.4%的盐酸中加入
,用pH计测得混合液的
7(填">"、"="或"<")。综合(1)和(2)证明猜想Ⅱ成立。
试题篮
()