从古至今,铁及其化合物一直被人类广泛应用。
(一)铁及其化合物的应用

(1)明代科学著作《天工开物》中记载:
①“其器冶铁锥,其尖使极刚利”,“铁锥”为开挖盐井的工具。所取盐井水“入于釜中煎炼顷刻结盐”,“金”指生铁制作的铁锅。生铁属于 材料。上述描述中利用铁的 (选填序号)。
| A. |
a.导热性 |
| B. |
b.导电性 |
| C. |
c.硬度大 |
②“泥固塞其孔,然后使水转釉”是指高温下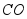 将红砖中的
将红砖中的 转化为
转化为 而形成青砖。该转化的化学方程式为 。
而形成青砖。该转化的化学方程式为 。
(2)铁的化合物在现代更多领域发挥着重要作用。
①碳酸亚铁( )不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
)不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
②火星探测器发回的信息表明,火星上存在 ,从而证明火星表面曾经存在过水,其理由为 。
,从而证明火星表面曾经存在过水,其理由为 。
③活性 可除去石油开采过程中的有害气体
可除去石油开采过程中的有害气体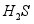 ,并获得
,并获得 ,原理如下。
,原理如下。
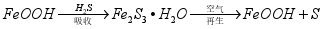
吸收中生成的另一种物质的化学式为 ,再生时发生反应的化学方程式为 。
(二) 的制备
的制备
用废铁屑(主要成分为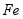 ,含少量
,含少量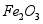 和
和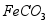 )制备
)制备 主要流程如下。
主要流程如下。
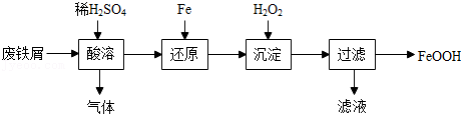
(1)酸溶时适当提高反应温度和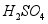 浓度,目的是 ,产生的气体为 。
浓度,目的是 ,产生的气体为 。
(2)还原发生的反应为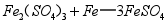 。
。
沉淀发生的反应为 。
。
沉淀时反应温度不宜太高,原因是 。
(3)沉淀时会有部分 与
与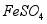 反应生成
反应生成 ,反应的化学方程式为 。
,反应的化学方程式为 。
(三) 的含量测定
的含量测定
已知: 及铁的氧化物加热分解的温度如下。
及铁的氧化物加热分解的温度如下。

称取含 的
的 样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
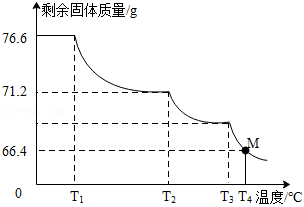
(1)样品中 的含量为 %(精确到0.1%)。
的含量为 %(精确到0.1%)。
(2)当加热到 时,M点固体的成分是 ,对应的质量比为 。
时,M点固体的成分是 ,对应的质量比为 。
氢是实现碳中和的能源载体。
(1)煤制氢的原理可表示为 。
① 中肯定含有的元素是 。
②煤制氢的不足是 (写出一点)。
(2)甲烷制氢包括重整、转化和分离等过程。甲烷制氢过程中产生的 和 的混合气分离得到 的过程如下:
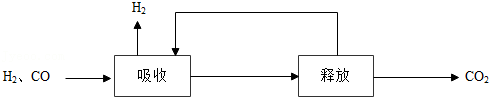
①海水作为吸收剂时,下列措施有利于海水吸收二氧化碳的是 (填序号)。
a.升高海水的温度
b.加快混合气的流速
c.增大气体的压强
②利用 溶液吸收 ,将其转化为 , 在加热条件下即可分解生成 。比较 和 分解反应的不同,可推知 的稳定性 (填“>”或“<”) 的稳定性。
③使用氢氧化钠溶液吸收二氧化碳并分离出氢气。补充完整氢氧化钠循环使用的方案。
步骤1:将氢气和二氧化碳的混合气通入足量的氢氧化钠溶液中。
步骤2:向步骤1所得的溶液中 。
步骤3:过滤,得滤渣和氢氧化钠溶液。
(3)某种利用太阳能制氢的过程如图1所示。
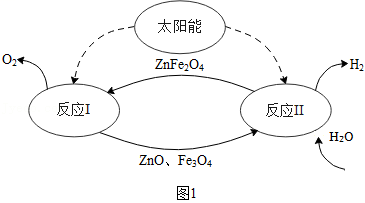
①反应I的基本类型为 。
②写出反应Ⅱ的化学方程式: 。
(4)我国2030~2050年各种能源使用预期情况如图2所示。
①图2所涉及的能源中,属于不可再生能源的是 。
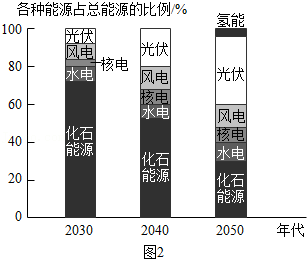
②2030~2050年,预期我国能源结构的变化趋势是 。
是化学实验中常见试剂。
(1)验证质量守恒定律。
步骤1:在锥形瓶中加入适量的 溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有 溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为 。
步骤2:将铁钉浸入到 溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有 溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为 。
①用砂纸将铁钉打磨干净的作用是 。
②步骤2中可观察到明显的实验现象是 。该变化可说明 和 的金属活动性由强到弱的顺序是 。
③若 ,可证明参加反应的 和 的质量总和等于 。
(2)探究 溶液对 分解具有催化作用。
①若要证明 溶液对 分解具有催化作用,除需证明 在反应前后化学性质和质量不发生改变外,还需证明的是 。
②为探究 在反应前后质量是否发生改变,某同学设计如下实验:
向 溶液中滴入10g a%的 溶液,待反应完全后,向试管中加入足量的 溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为 。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物 计算出溶液中 的质量 。(填“大于”或“小于”或“等于”)
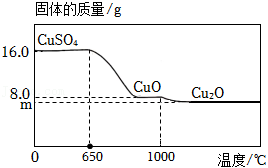
(3)将16.0g 置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
①650℃时, 开始发生分解反应,生成 和另一种氧化物 , 的化学式为 。
②1000℃时, 开始发生分解反应,生成 和 。计算图中 的值。(写出计算过程,否则不得分)
硫酸是世界上产量最大、用途最广的酸,被称为“化学工业之母”。化学兴趣小组同学对硫酸进行了多角度的研究。
【物质制备】
(1)工业上采用接触法制硫酸:先煅烧黄铁矿得到 ,再将 经过一系列变化得到硫酸。 中硫元素的化合价是 。
【物质性质】
(2)用温度计的水银球一端蘸取浓硫酸,取出后在空气中放置一段时间,观察到温度计示数上升,是因为浓硫酸能吸收 ,并放出热量。
(3)请利用如图提供的仪器与药品,探究稀硫酸与氢氧化钠溶液的反应。
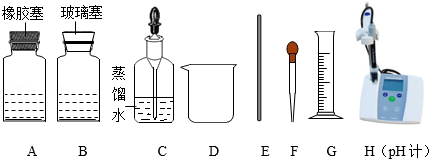
①取 (填“A”或“B”)中的氢氧化钠溶液5mL加入烧杯中,并插入pH计。
②从另一试剂瓶中取出稀硫酸逐滴加入①的溶液中,并用 (填仪器名称)不断搅拌。反应过程中溶液pH变化的部分数据如下表所示:
|
稀硫酸体积/mL |
0 |
2 |
4 |
6 |
8 |
…… |
|
溶液pH |
13.1 |
12.8 |
12.3 |
11.5 |
10.4 |
…… |
③在pH=12.8时,溶液中的溶质是 (填化学式)。
④滴加稀硫酸过程中,溶液pH不断减小的原因有:
a.硫酸与氢氧化钠发生了反应;
b.
⑤为证明溶液pH从13.1减小到10.4的过程中,④中原因a起主要作用,需设计的实验方案是 。
【定量研究】
(4)某工厂现有含碳酸钠的废水需要处理。为测定废水中碳酸钠的质量分数,化学兴趣小组同学取废水样品100g,加入溶质质量分数为10%的硫酸溶液9.8g,恰好完全反应,反应的化学方程式: (此废水中其他物质不与硫酸反应)。计算废水中碳酸钠的质量分数(写出计算过程)。
化学兴趣小组设计了如图所示两个装置,以 溶液为原料制备 ,可灵活控制气体的产生与停止。

(1)甲装置用 作催化剂,先用黏合剂将 粉末制成团状。
①仪器a的名称是 。
②团状 应放在 (填“试管底部”或“多孔隔板上”)。
③打开活塞K,经仪器a向试管中缓慢加入 溶液至浸没团状 ,立即产生 ,收集完后, (填操作),反应随后停止。
(2)乙装置用铂丝(可上下抽动)作催化剂。安全管下端浸没于 溶液中,将铂丝插入溶液,立即产生 。
①若烧瓶内压强过大,安全管中出现的现象是 。
②当出现上述现象时,应采取的措施是 。
(3)取100g 溶液加入乙装置的烧瓶中,完全反应后,测得生成2.56g 。计算 溶液的溶质质量分数(写出计算过程)。
化学兴趣小组利用中和反应测定某 溶液的浓度,实验过程如下:
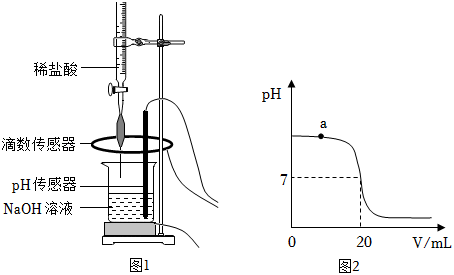
(1)配制稀盐酸:取 的浓盐酸,加水稀释成 的稀盐酸。所得稀盐酸中溶质的质量为_____;
(2)常温下,测定 溶液浓度:
Ⅰ.取 待测 溶液于烧杯中,按图1所示将上述稀盐酸滴入,通过数字化传感器同时测定滴入烧杯内盐酸的体积和烧杯内溶液的 ,得到如图2所示曲线。
Ⅱ.当 溶液与稀盐酸恰好完全反应时,所得溶液的 为_____。经计算,此时已滴入烧杯内的稀盐酸中,所含溶质的质量为 。
设 溶液中溶质的质量为 。
列出比例式__________
求解
答: 溶液中溶质的质量分数为 __________(列式并计算结果);
(3)写出a点对应的溶液中大量存在的分子、离子__________(用化学符号表示)。
某同学在学习质量守恒定律时,称取 镁条进行燃烧实验(如图)。
(1)计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。
(2)该同学称得反应后固体的质量小于 ,原因可能是_____。
二甲基亚砜( )工业废渣含 及少量有毒的 ,以该废渣为原料制备农用 ,既实现资源回收利用又保护了环境。工艺流程如下:
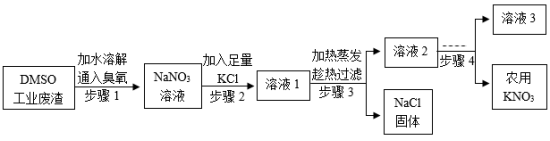
(1)农用 为农作物提供的营养元素有_______。
(2)步骤1的作用是除去 , 中氮元素的化合价为_______。
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出 固体,原因是_______。
(4)步骤4的操作是_______、过滤。
(5) 用量的估算依据是 (填标号)。
| A. | 与 的粒子个数比为 |
| B. | 与 的质量比为 |
| C. | 与 在溶液中的质量分数之比为 |
(6)该工艺所得农用 混有一定量 。取 样品加足量水溶解,向溶液中加入足量的 溶液,生成沉淀的质为 ,则样品中杂质 的质量是_____ ,样品含 _______ (质量分数)。
(相对分子质量: )
一班的同学在探究金属镁的化学性质时发现,将镁条放到盛有冷水的试管中,没有明显的现象,然后将试管放在酒精灯上加热,发现试管中有气泡产生。
(1)小明认为,据此现象可断定加热时镁能和水反应,小强认为小明的结论不正确,理由是 。
(2)小明向加热的试管中滴入酚酞溶液,溶液显红色,证明镁在加热时 (填"能"或"不能")与水发生反应
(3)小明将加热后的试管放置在空气中一段时间后,同学们发现溶液中的红色消失了。
在确定酚酞溶液没有变质的情况下,请你根据初中所学化学知识,对溶液中红色消失的原因做出合理猜想。
猜想一:
猜想二:
请设计实验方案,对其中一种猜想进行验证 。(只需答出实验方案,不需要回答现象和结论)
海洋中有丰富的水生生物和化学资源。海水晒盐能得到粗盐和苦卤,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题。
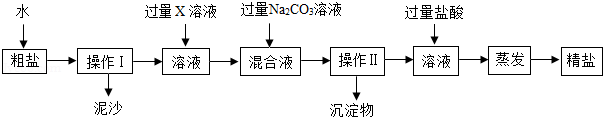
(1)蒸发过程中使用到玻璃棒,其作用是 。
(2)若要去除粗盐中可溶性的杂质氯化镁和氯化钙,可依次加入过量的X和碳酸钠两种溶液。下列物质中,可作为X的物质有 。
A、KOH
B、Ba (OH) 2
C、Ca(OH) 2
D、NaOH
(3)操作Ⅱ后向所得滤液中加入适量的盐酸,其目的是 ,最后通过蒸发结晶得到较为纯净的氯化钠。
一班的同学在探究金属镁的化学性质时发现,将镁条放到盛有冷水的试管中,没有明显的现象,然后将试管放在酒精灯上加热,发现试管中有气泡产生。
(1)小明认为,据此现象可断定加热时镁能和水反应,小强认为小明的结论不正确,理由是 。
(2)小明向加热的试管中滴入酚酞溶液,溶液显红色,证明镁在加热时 (填“能”或“不能”)与水发生反应
(3)小明将加热后的试管放置在空气中一段时间后,同学们发现溶液中的红色消失了。
在确定酚酞溶液没有变质的情况下,请你根据初中所学化学知识,对溶液中红色消失的原因做出合理猜想。
猜想一:
猜想二:
请设计实验方案,对其中一种猜想进行验证 。(只需答出实验方案,不需要回答现象和结论)
海洋中有丰富的水生生物和化学资源。海水晒盐能得到粗盐和苦卤,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题。

(1)蒸发过程中使用到玻璃棒,其作用是 。
(2)若要去除粗盐中可溶性的杂质氯化镁和氯化钙,可依次加入过量的X和碳酸钠两种溶液。下列物质中,可作为X的物质有 。
A、KOH
B、Ba (OH)2
C、Ca(OH) 2
D、NaOH
(3)操作Ⅱ后向所得滤液中加入适量的盐酸,其目的是 ,最后通过蒸发结晶得到较为纯净的氯化钠。
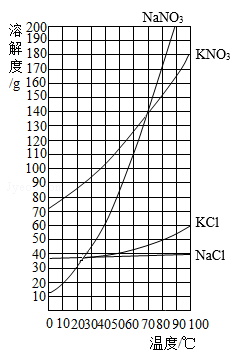
某化学小组从理论上初步探究"已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾"。
【分析提纯方法】
表一:常温下(20℃)溶解度和溶解性的关系
| 溶解度S |
S≥10g |
1g≤S<10g |
0.01g≤S<1g |
S<0.01g |
| 溶解性 |
易溶 |
可溶 |
微溶 |
难溶 |
表二:硝酸钾和氯化钠在不同温度时的溶解度
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
KNO 3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
| NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
(1)常温下,KNO 3和NaCl的溶解性均为 。
(2)根据表中数据,绘制KNO 3的溶解度曲线。
(3)根据KNO 3的溶解度曲线,获得KNO 3在70℃时的溶解度约为 g。
【设计提纯步骤】
(1)选取样品(95gKNO 3和5gNaCl的混合物)
(2)配制80℃时KNO 3的饱和溶液(加水约56.2mL,水的密度约为1g•mL ﹣ 1)
(3)降温至20℃
(4)得到晶体
【设计提纯方案】
为了证明(4)中得到的晶体为纯净的KNO 3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水和固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加 ,观察实验现象。
方案二 计算析出KNO 3晶体的质量约为 g(精确到0.1g)与(4)中得到晶体的质量进行比较
方案三 与95%进行比较。
方案四 。

化学变化的本质特征是有新物质生成,化学变化中的一些现象有助于我们判断物质是否发生了化学变化,
分析一:化学变化中的现象
| 实验内容 |
实验现象 |
实验分析 |
| (1) 木炭在氧气中燃烧 |
发出白光,发出热量 |
燃烧是 的剧烈的化学反应 |
| (2) |
镁表面 铜无明显变化 |
镁与稀盐酸反应,铜不与稀盐酸反应 |
| (3) |
产生白色沉淀 |
该反应的化学方程式
|
| (4) |
玻璃管内的固体由红棕色变为 色 |
发生了化学变化 |
分析二:有助于判断草酸(H 2C 2O 4)溶液与酸性KMnO 4溶液发生化学变化的现象是什么?(单酸晶体溶于水形成无色溶液,酸性KMnO 4溶液是H 2SO 4与KMnO 4的混合溶液)结合已有知识,进行大胆猜想:
(1)现象及可能产生该现象的依据
(2)现象及可能产生该现象的依据 。
根据表中信息,请回答下列问题。
| 测试类别 S化合价 |
氢化物 |
单质 |
① |
酸 |
盐 |
| +6 |
﹣ |
﹣ |
SO 3 |
H 2SO 4 |
Na 2SO 4CuSO 4FeSO 4(NH 4) 2SO 4 |
| ② |
﹣ |
﹣ |
SO 2 |
H 2SO 3 |
Na 2SO 3 |
| 0 |
﹣ |
S |
﹣ |
|
|
| ﹣2 |
H 2S |
﹣ |
﹣ |
H 2S |
Na 2S |
(1)填写表中内容:① ;② 。
(2)物质可以按照一定规律发生转化,请按要求各写出一个对应的化学方程式。
①置换反应 ;②复分解反应 。
(3)(NH 4) 2SO 4是农业上常用的铵态氮肥,在实验室检验其为铵态氮肥的实验操作是______(写出一种即可)
(4)2H 2S+SO 2═2S+2H 2O,反应前后硫元素化合价发生的变化是
(5)在实验室中,可用热的碱液除去试管内壁上附着的硫,请完成该反应的化学方程式: S+ NaOH═ Na 2SO 3+ + H 2O。
试题篮
()