25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2﹣最低浓度的对数值lgc(S2﹣)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
| A.25℃时K(CuS)约为1×10﹣35 |
| B.向100mLZn2+、Cu2+浓度均为10﹣5mol•L﹣1的混合溶液 中逐滴加入10﹣4mol•L﹣1的Na2S溶液,Cu2+先沉淀 |
| C.Na2S溶液中:c(S2﹣)+c(HS﹣)+c(H2S)═2c(Na+) |
| D.向Cu2+浓度为10﹣5mol•L﹣1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
在体积均为1.0L的两个恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A.反应CO2(g)+c(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ) >2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )

| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O |
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为 mol
mol
③反应过程中转移的电子数为 mol
mol
④生成标准状况下NO气体的体积为 L
L
⑤与合金反应反应的硝酸的物质的量为( +
+ )mol
)mol
| A.2项 | B.3项 | C.4项 | D.5项 |
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
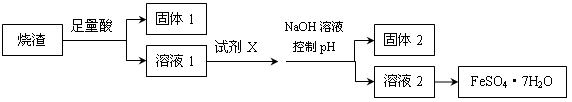
下列说法不正确的是( )
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
| D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
向1LFeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br一)=3c(Cl一),反应过程中溶液的体积变化忽略不计,则下列说法中正确的是( )
| A.原溶液的浓度为0.1mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c(Br一)=0.4mol/L |
下列离子方程式中书写正确的一组是( )
① 向明矾溶液中加入Ba(OH)2溶液至A13+ 刚好完全沉淀:
Al3++ SO42-+3OH-+Ba2+= BaSO4↓+Al (OH)3↓
② 氟气和水反应:2F2+2H2O = 4H++4F-+O2
③ 向澄清石灰水中加入少量小苏打溶液:
Ca2++OH-+HCO3- = CaCO3↓+H2O
④ 铜片投入稀HNO3溶液:Cu+NO3-+4H+ = NO↑+2H2O+Cu2+
⑤ 钠与水反应:Na +2 H2O = Na+ +OH— + H2↑
⑥ 碳酸钙放入盐酸中: CO32- + 2H+ = CO2↑ +H2O
⑦ 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
⑧ 过量氯水与FeI2溶液作用: 2Fe2+ + 2I—+ 2Cl2 =" 2" Fe3+ + I2 + 4Cl—
| A.①②③④ | B.③⑦ | C.①③④⑤ | D.①④⑥⑦⑧ |
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO),向反应后的溶液中加入3mol/LNaOH溶液到沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1g.下列叙述不正确的是( )
| A.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
| B.参加反应的金属的总质量3.6g<m<9.6g |
| C.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100mL |
| D.当金属全部溶解时收集到NO气体的体积在标况下为2.24L |
某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成.
②另取少量原溶液,逐滴加入5mL0.2mol•L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量 基本不变后产生气体,最后沉淀逐渐减少至消失.
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g.
下列说法中正确的是( )
| A.该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
某温度下,饱和石灰水的溶解度为Sg,密度为ρg/mL,向足量该饱和溶液中加入mgCaO,充分作用后,恢复到原来温度,下列有关说法不正确的是( )
| A.最终得到沉淀的质量大于 37m/28g |
| B.该饱和溶液质量百分比浓度为 s/(100+s)% |
| C.最终所得溶液PH不变 |
D.该饱和溶液中溶质物质的量浓度为 |
已知HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
根据下列框图,有关说法正确的是( )

| A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B.反应⑤的离子方程式可表示为:2E(OH)3+3Cl2+6H2O═3EO42-+6Cl-+12H+ |
| C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性 |
| D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42-+4H2O+3e-═E(OH)3+5OH- |
常温下,在10mL0.1 mol•L-1Na2CO3溶液中逐滴加入0.1 mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
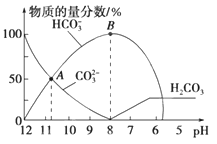
| A.在0.1mol•L-1Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20mL |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
试题篮
()