《有机化学基础》
(1)根据结构对有机物进行分类,有助于对其性质的掌握。
① 有机物苯属于 (填字母)。
a.芳香烃 b.烯烃 c.炔烃
② 下列有机物属于酚类的是 (填字母)。

③ 纤维素属于 (填字母)。
a.糖类 b.油脂 c.蛋白质
(2)柴胡红景天中的活性成分之一是鞣花酸(结构式如右图)。
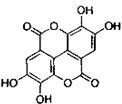
①鞣花酸的分子式为 ;
②鞣花酸分子中含氧官能团为 和 (写名称);
③1mol鞣花酸最多可与 mol Br2发生取代反应;
1mol鞣花酸最多可与含 mol NaOH的溶液发生反应.
(3)莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.

①区别两种酸的方法是 。
莽草酸与溴水的反应方程式: 。
②等物质的量的两种酸与足量NaOH溶液反应,消耗氢氧化钠物质的量之比是 。
③鞣酸的核磁共振氢谱图(H核磁共振谱图)上有 个吸收峰。
本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
(1)改善环境质量已成为全球共识。保护环境,人人有责。
①空气质量报告的各项指标可以反映出该地区的空气质量状况,下列不需要监测的成分是 (填字母)。
A. SO2 B. N2 C. 可吸入颗粒物
②pH< 的雨水称为酸雨,煤炭燃烧产生的SO2所形成的酸雨,其最终的主要成分是 (填化学式)。
③煤中加入石灰石可以大大减少SO2的排放,发生反应的化学方程式: 。
(2)保持营养均衡,合理使用药物是人类健康的重要保证。
①人体内提供能量的主要营养物质为 、糖类和蛋白质,人体内蛋白质在蛋白酶作用下水解的最终产物是 。
②维生素C能防治坏血病并具有还原性,验证维生素C有还原性可以使用淀粉溶液和 试剂共同完成。
③咽喉发炎的病人可以使用药物 (填“氢氧化铝”或“青霉素”),起到杀菌消炎作用。
④阿司匹林(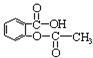 )在人体内可以水解为水杨酸(
)在人体内可以水解为水杨酸( 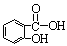 )和一种生活中常见的酸味剂,具有解热镇痛疗效,写出其水解的化学方程式: 。
)和一种生活中常见的酸味剂,具有解热镇痛疗效,写出其水解的化学方程式: 。
(3)(4分)材料是人类生活的物质基础,新型材料的制造则是科技快速发展的重要标志。
①钢铁是制造铁路、桥梁、轮船等的主要材料,钢铁在潮湿的空气中主要发生 腐蚀(填“吸氧”或“析氢”),腐蚀时Fe作为原电池的 极。
②目前,很多地方使用的泡沫塑料快餐具的主要成分是聚苯乙烯(简称EPS),聚苯乙烯属于 (填字母)。
A. 无机非金属材料 B. 金属材料 C. 有机高分子材料
③工业上生产玻璃、水泥都要用到的原料是 。
氮氧化物进入大气后,可能会形成硝酸型酸雨,因此必须对含有氮氧化物的废气进行处理。
(1)用NaOH可以吸收废气中的氮氧化物,反应的化学方程式如下:2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH
NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH  2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
(2)NO2和Br2蒸汽都是红棕色气体,下列可以用来鉴别这两种气体的试剂是 。
| A.用氢氧化钠溶液 | B.淀粉碘化钾溶液 | C.用硝酸银溶液 | D.用蒸馏水 |
(3)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气无污染的气体,该反应的化学方程式为 。
(4)氨气也可用来处理氮氧化物,例如:氨气与二氧化氮反应生成氮气和水,写出该反应的化学方程式: ,若某工厂排出的废气中二氧化氮含量为0.5%(体积分数),处理1000m3(标准状况)这种废气,需要 千克氨气。(结果保留两位小数)
我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应: KIO3 + KI + H2SO4  K2SO4 + I2 + H2O
K2SO4 + I2 + H2O
(1)将上面氧化还原反应的化学方程式配平。
(2)该反应中氧化剂和还原剂的物质的量之比为 。
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为
(4)若要提取生成的碘,所用的萃取剂可以是 (填序号)。
①水 ②酒精 ③淀粉溶液 ④苯
(5)加碘食盐不能长时间炖炒,且应避热保存,主要原因是 。
(1)MgCl2的摩尔质量是 ;0.1mol CO2在标准状况下体积约是 ;0.2 mol·L-1的Cu(NO3)2溶液中NO3-的物质的量浓度是 。
(2)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用相应序号填空:能导电的是 ;属于电解质的是 。
(3)CH3COOH的电离方程式为 。
2015年巴黎气候变化大会的主题之一是节能减排,开发新能源以及提高能源的利用率再次受到国际社会的高度关注。
(1)近年我国努力调整能源结构,开发新能源。下列物质中,属于可再生能源的是________(填字母)。
A、氢能 B、天然气 C、石油
(2)已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-l
2C(s)+O2(g)=2COg) △H=-221.0 kJ·mol-l
2CO(g)+O2(g)=2CO(g) △H=-556.0 kJ·mol-l
请回答下列问题:
①l g H2(g)在氧气中完全燃烧生成H2O(g)时放出的热量为______________kJ。
氢气被称为绿色能源的主要原因是____________________。
②若18 g C(s)氧气中不完全燃烧,生成的CO(g)与CO2(g)的物质的量之比为2:l,
则该过程放出的热量比等质量的C(s)在氧气中完全燃烧时要少______________kJ。
③将煤转化为水煤气(H2、CO的混合气)是将煤转化为清洁燃料的方法之一。
则C(s)与H2O (g)反应制备水煤气的热化学方程式为__________________________。
(3)工业上可通过CO(g)和H2(g)化合来制备可再生能源CH3OH(g):
CO(g)+2H2(g)=CH3OH(g) △H=-99 kJ·mol-l
又知该反应中某些物质分子里的化学键的键能数据如下表:

如CO中的C与O之间为叁键连接,则C≡O键的键能为___________kJ·mol-l。
某有机化合物A广泛存在于多种水果中。
(1)经测定,A中仅含有C、H、O三种元素,67 gA在空气中完全燃烧时可生成27g H2O和88 g CO2。则A的实验式或最简式为________________。
若要确定A的分子式,还需要知道A的相对分子质量,测定物质的相对分子质量可以采用___________(填“质谱”或“红外光谱”)法。
经测定A的相对分子质量为134,则A的分子式为_______________。
(2)又知1 molA与足量的NaHCO3溶液充分反应可生成标准状况下的C02气体44.8 L,
l molA与足量的Na反应可生成1.5 mol的H2,则A分子中所含官能团的名称为_________。
(3)若A分子中不存在甲基且有一个手性碳原子,则A的结构简式为________________。
该A在浓硫酸存在下加热,可以生成多种产物,请写出A发生消去反应后所得有机产物的结构简式________________。
(4)A的一种同分异构体B,与A所含官能团的种类和数目均相同,且能催化氧化成醛,则B的1H核磁共振谱图中将会出现__________组特征峰。
合理使用药物是保证身心健康、提高生活质量的有效手段。药物化学已经成为化学的一个重要领域。
(1)我国科学家屠呦呦因发现治疗疟疾的特效药——青蒿素,而获得2015年诺贝尔生理学或医学奖。青蒿素的结构简式如右图所示,其含有的过氧基(—O—O—)具有强氧化性。

请回答下列问题:
①青蒿素的分子式为_______________________。
②下列有关青蒿素的叙述中,正确的是__________(填字母)。
A、青蒿素属于芳香族化合物
B、青蒿素具有强氧化性,可用于杀菌
C、青蒿素分子中的所有碳原子在同一个平面上
D、在一定条件下,青蒿素能与NaOH溶液发生反应
(2)阿司匹林(乙酰水杨酸)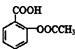 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
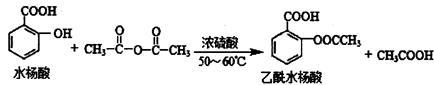
请回答下列问题:
①乙酰水杨酸中的含氧官能园的名称为____________________。
②制得的阿司匹林中常含有少量的杂质水杨酸,下列试剂可用于检验阿司匹林样品中是否混有水杨酸的是________________(填字母)。
A、碳酸氢钠溶液 B、三氯化铁溶液 C、石蕊试液
③写出水杨酸与足量的NaHCO3溶液完全反应所得有机产物的结构简式:_____________。
④1 mol乙酰水杨酸与足量的NaOH溶液反应,最多消耗NaOH物质的量为_________mol。
下表给出了ABCDE五种有机物的有关信息
请根据表中信息回答下列问题:
(1)将A通入到少量的溴的四氯化碳溶液中,主要现象是____________________。
(2)B分子的空间构型为___________________。
(3)实验室用C制取少量的A的反应条件为:以浓硫酸作催化剂、温度为_______℃。
(4)C与E发生反应的化学方程式为_______________________________。
(5)D与新制的氢氧化铜的悬浊液反应的化学方程式为___________________________。
(6)E的一种同分异构体F既能在NaOH溶液中发生水解反应,又能与银氨溶液反应,则F的结构简式为______________________。
按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______________。
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中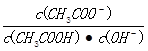 不变
不变
D.溶液中 减小
减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=______________________(溶液体积变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是____。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是_____________。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]___________Ksp[Mg(OH)2](填“>”、“=”或“<”)
铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
| ⅠFe(s)+CO2(g)= FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
| ⅡFe(s)+H2O(g)= FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
| ⅢCO(g)+H2O(g)= CO2(g)+H2(g) |
K3 |
? |
? |
完成下列填空:
(1)反应Ⅰ是________(选填“吸热”,“放热”)反应。根据反应Ⅰ与Ⅱ可以推导出同温下K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(2)973K时,若反应Ⅲ在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)=__________。若压缩容器的容积为原来的一半,平衡将________移动(选填“向左”,“向右”,“不”),CO2的浓度将________(选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有________。
铁是用途最广泛的金属材料之一,但生铁易生锈,请讨论电化学实验中有关铁的性质。
(1)某原电池装置如图所示,右侧烧杯中的电极反应为_________,左侧烧杯中的c(Cl-)________(填“增大”“减小”或“不变”)。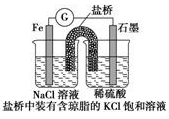
(2)已知下图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
(3)用高铁酸盐设计的高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极电极反应式________________________________。
②用高铁电池做电源,以铁为阳极,以铜作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2________L。(标准状况)
有效利用现有资源是解决能源问题的一种实际途径,发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)以CO和CO2分别与H2为原料,在一定条件下均可合成甲醇(CH3OH)。你认为用哪种合成设计路线更符合“绿色化学”理念:(用化学反应方程式表示)____________;
(2)下图表示在恒容容器中230℃催化剂条件下,0.5molCO2和1.5molH2反应得到甲醇蒸气,产率达80%时的能量变化示意图。

①写出该反应的热化学方程式:_____________________。
②能判断该反应达到化学平衡状态的依据是_____________________。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中气体密度不变
(3)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:负极______。

(4)“催化还原”反应制乙二醇(HOCH2-CH2OH)原理如下:
CH3OOC-COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究,下图表示乙二醇达平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强时P(丙)=___________。

(5)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸。H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示曲线①代表的粒子是___________;草酸氢钾溶液中存在如下平衡:H2O H++OH-,HC2O4-
H++OH-,HC2O4- H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)
H++C2O42-和___________;一定温度下,往CaC2O4饱和溶液[已知Ksp(CaC2O4=2.3×10-9)]中加入少量CaCl2固体,c(Ca2+)将_________,CaC2O4的溶解度将____________。(填“增大”“减小”或“不变”)

甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
(1)常温下将0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①0.2mol/LHCl溶液中由水电离出的c(H+)__________0.2mol/LMOH溶液中由水电离出的c(H+); (填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_________mol/L。
(2)常温下若将0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH>7,则说明在相同条件下MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,则混合溶液的pH_______。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示:
| 实验序号 |
0.1032mol/LHCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
25.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为_________mol/L。(保留四位有效数字)。
②下列情况可能引起测定结果偏高的是__________。
A.锥形瓶未用待测液润洗
B.酸式滴定管未用标准盐酸溶液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10-10 |
5.0×10-13 |
8.3×10-17 |
2.0×10-48 |
1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________。
A.KI B.K2CrO4 C.KBr D.K2S
试题篮
()