下列共有四组物质,请按要求回答下列问题
| |
X |
Y |
Z |
| ① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
| ② |
MgCl2溶液 |
酚酞溶液 |
NaCl溶液 |
| ③ |
Na2O |
Na2CO3 |
NaHCO3 |
| ④ |
KOH溶液 |
Al |
稀盐酸 |
(1)同组物质中,X、Y、Z均是属于电解质的是 (填数字符号)。
(2)同组物质中,Y既能与X发生氧化还原反应,又能与Z发生氧化反应反应的是 (填数字符号)。
(3)写出第①组X与Y反应的离子方程式 。
(4)若只用一种试剂即可将第②组物质区分开来,该试剂是 。
(5)第③组固体Y中混入了少量的Z,除去少量的Z的最好方法是 。
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是____________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有____________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是____________。
| A.NaCl | B.NH4Cl | C.HNO3 | D.浓H2SO4 |
(1)0.5 mol CO2的质量为___________,其中含有__________个CO2分子,在标准状况下的体积是 。
(2)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为____________。
(3)想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液体)这三种物质为什么可以归为一类,下列哪些物质可以和它们归为一类 (填序号)。
A 75%的酒精溶液 B 硝酸钠 C 碱石灰 D 豆浆 E 过氧化钠
(4)洁厕灵(强酸性,含盐酸)与84消毒液(碱性,含NaClO)混用可能使人中毒。请写出中毒涉及反应的离子方程式 。
某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图。请完成下列问题。
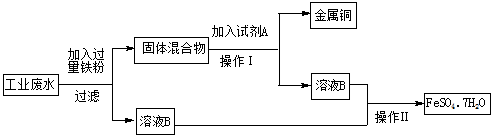
(1)检验工业废水中含有Fe3+的方法是 。
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为 。
(3)操作Ⅰ为 。
(1)将117 g NaCl溶于水配制成1 L溶液,该溶液中NaCl的物质的量浓度为 。
(2)在标准状况下,将V L A气体(摩尔质量为M)溶于0.1 L水中,所得溶液的密度为,则此溶液的物质的量浓度为 。
(3)某硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 。
A.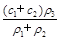 |
B.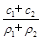 |
C.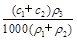 |
D.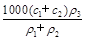 |
我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
(1)用双桥法标出电子转移的方向及数目
S+2KNO3+3C = K2S+N2↑+3CO2↑
(2)该反应中还原剂是 ,氧化剂是 。
某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
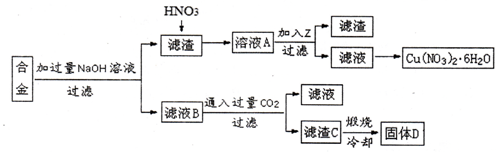
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
铝、铁是重要的金属,其单质及化合物有着广泛的应用,完成下列填空:
(1)铝元素在周期表中的位置是 ,写出其最高价氧化物对应水化物的电离方程式 。
(2)画出铁原子的结构示意图 。与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为 。
(3)在FeC13稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;在其中加入少量KCl固体,溶液的颜色 (选填“变深”,“变浅”或“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加溶液,则不呈红色,若再加入足够量FeC13溶液,又会呈现红色。请试对上述实验现象作出解释 。
铁、铝是应用最广泛的两种金属。完成下列填空:

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,它们互称为 ,其中58Fe原子中子数与质子数之差为 。
(2)工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁 。
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出该反应的化学方程式 ,该反应是 (填“吸”或“放”)热反应。
(4)铁粉中混有少量的铝粉,请设计一种实验方案除去铁粉中的铝粉
(5)向某溶液中投入铝片后有大量的H2放出,溶液中不可能大量存在的离子是 (填序号)
a.Cl- b.H+ c.OH- d.HCO3-
(6)铁与稀硝酸反应的方程式如下:3Fe+8HNO3 →3Fe(NO3)2+2NO↑+4H2O
该反应的氧化剂是 ,氧化产物是 ,每转移1.8mol电子,生成NO L(标准状况)。
合成尿素的反应为: 完成下列填空:
完成下列填空:
(1)写出NH3的电子式 ;画出碳原子结构示意图 ;氧元素位于周期表第 周期第 族。
(2)上述反应所涉及的4种元素,原子半径从大到小的排列顺序为 。
(3)上述反应所涉及的4种元素中,非金属性最强的是 。
(4)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中水蒸气0.6mol,则平均反应速率v(NH3)= mol/(L·min)。
(5)下列能说明上述反应己达平衡的是 。(填序号)
a.2c(NH3)=c(H2O) b.CO2的浓度不变
c.v正(NH3):v正(CO2)=2:1 d.气体的压强不变
(6)为提高氨气的转化率,工业上用该反应生产尿素时,合适的反应条件是 。(填序号)
a.200℃ b.800℃ c.101kPa d.24000kPa
(1)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍。回答下列有关问题:

如图所示:
①甲池通入CH3OH的电极反应式为 ;乙池石墨一极的电极反应式为 ;
②反应一段时间后,向乙池中加入一定量 能使CuSO4溶液恢复到原浓度;
③甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生 g沉淀。
(2)工业上有一种生产甲醇的反应:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1
CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1
在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 |
A |
B |
| 反应物投入量 |
1mol CO2(g)和3mol H2(g) |
1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)浓度(mol•L-1) |
c1 |
c2 |
| 反应能量变化 |
放出29.4kJ |
吸收akJ |
①从反应开始至达到平衡时,A中用CO2来表示的平均反应速率为 ;
②该温度下,反应CO2( ) + 3H2(
) + 3H2( )
) CH3OH(
CH3OH( ) + H2O(
) + H2O( ) 的化学平衡常数的值为 ;
) 的化学平衡常数的值为 ;
③a= 。
④下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
根据下图填空:
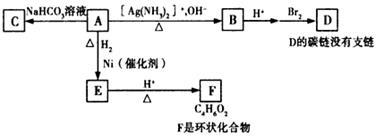
已知:1 mol A与2 mol H2反应生成1 mol E
(1)化合物A含有的官能团名称是 。
(2)B在酸性条件下与Br2反应得到D,写出D与足量NaOH溶液反应的化学方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)写出E的结构简式 。
(5)写出A→B的化学方程式 。
利用周期表中同族元素的相似性,可预测元素的性质。
(1)P元素的基态原子有_______个未成对电子,白磷的分子式为P4,其结构如下图所示。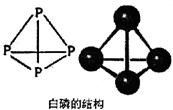
科学家目前合成了N4分子,N原子的杂化轨道类型是________,N -N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途为________。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3)立方氮化硼晶体的结构如下图所示:
该晶体中,B原子填充在N原子的________空隙,且占据此类空隙的比例为________ (填百分数)。
(4) N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是________;立方砷化镓晶体的晶胞边长为a pm,则其密度为________g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
过氧化碳酰胺(CO(NN2)2·H2O2)是一种白色晶体,易溶于水和有机溶剂,稍高温度时(>45℃)即分解,可作为高效、安全、方便的固体消毒剂。工业上常用湿法合成,工艺流程如下:
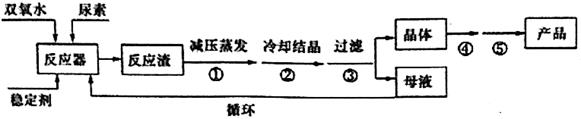
(1)反应器中发生的反应为:CO(NH2)2+H2O2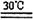 CO(NN2)2·H2O2 △H <0,应采取_______方式加热,从母液中循环利用的物质为________。
CO(NN2)2·H2O2 △H <0,应采取_______方式加热,从母液中循环利用的物质为________。
(2)操作①采用减压蒸发的原因是________,操作④、⑤名称为________、________。
(3)过氧化碳酞胺也可用干法流程制取:
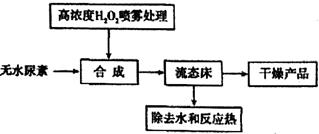
与湿法工艺对比,干法工艺的优点是________,缺点是________。
(4)为测定产品的纯度,称取3.0 g产品于锥形瓶中,加适量蒸馏水溶解,再加入几滴H2SO4,用0.2500 mol/L KMnO4标准溶液滴定,终点时消耗标准溶液40.00 mL〔己知:尿素与KMnO4溶液不反应)。
①完成并配平方程式:______MnO4-+______H2O2+ ______H+=_______Mn2 ++_____H2O+______
②产品纯度为________(结果保留到小数点后一位)。
科学家利用“组合转化”等技术对CO2进行综合利用。如用H2和CO2在一定条件下可以合成乙烯:6H2 (g) +2 CO2 (g)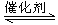 CH2=CH2 (g) +4H2O (g) △H="a" kJ/mol
CH2=CH2 (g) +4H2O (g) △H="a" kJ/mol
(1)己知:①H2和CH2=CH2的燃烧热分别为285.8kJ/mol和1411kJ/mol
②H2O (g)=H2O(1) △H="=-" 44 kJ/mol,则a="________" kJ/mol
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是________ (填序号)。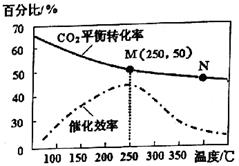
①M点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④为提高CO2的转化率应在尽可能低的温度下进行反应
(3)若在密闭容器中充入体积比为3:1的H2和CO2,则图中M点时,产物CH2=CH2的体积分数为________;若要进一步提高乙烯的体积分数,可采取的措施有________。
(4)科学家开发了一种新型陶瓷(主要成分为Li4SiO4 ),在500℃时可高效吸收CO2,同时生成Li2CO3;该材料在700℃时可再生循环。请写出表示该过程的化学方程式________。
(5)利用高温电解技术可将CO2转化为高热值的燃料CO: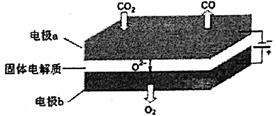
①电极a发生________ (填“氧化”或“还原”)反应。
②高温电解的总反应的化学方程式为________。
试题篮
()