(4、5班都做)某芳香烃A有如下转化:
请回答下列问题
(1)A的结构简式是 。
(2)属于取代反应的有 (填写序号)。
(3)D物质中含有的官能团名称是 。
(4)A→B ;E→F 。
(5)写出与A互为同分异构体的一种物质的结构简式 。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ;工业上制取A的离子方程式为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。
(4)若D是空气质量预报必报的无色有刺激性气味气体,A、B、C的的焰色反应都呈黄色,则B的化学式是 。
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:____________。
当温度降低时,化学平衡常数K值________(填“增大”、“减小”或“无影响”)。
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________(填字母)。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.0 mol,n(H2)=0.8 mol,n(NH3)=0.8 mol,则反应速率v(H2)=________,平衡常数=________。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”、“小于”或“等于”)原来的2倍。
(9分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
(1)环戊二烯分子中最多有 个原子共平面;
(2)金刚烷的分子式为 ,其分子中的-CH2-基团有 个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应①的产物名称是 , 反应②的反应试剂和反应条件 ,反应④的反应类型是 ;
(4)已知烯烃能发生反应:
请写出下列反应产物的结构简式: 。
。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、⑤的反应类型分别为________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是______________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写三种):
______________________________。
选考【化学——选修2化学与技术】(1 5分)将磷肥生产形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水台物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图: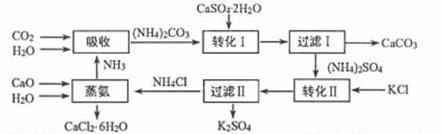
(1)本工艺中所用的原料除CaSO4·2H2O、CaCO3、H2O外,还需要的两种原料是____、____;写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:____。
(2)过滤I操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的操作方法是________。
(3)过滤I的滤液中的Ca2+浓度低于1×10—5mol/L时可认为被沉淀完全。若要使Ca2+沉淀完全,则滤渡中c(CO32-)大于____。[已知:该温度下
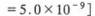
(4)写出“蒸氨”过程中的化学方程式:____。
(5)生产医用二水合氯化钙(CaCl2·2H2O )蒸发结晶要保持在160℃的原因是_______。氯化钙结晶水合物(CaCl2·6H2O )是目前常用的无机储热材料,选择的依据是______(填字母)。
a.熔点29℃较低 b.能导电 c.能制冷 d..无毒
按要求写方程式。
(1)碳酸钙和盐酸(写出离子方程式)
(2)氢氧化钡溶液和稀硫酸(写出离子方程式)
(3)Fe2(SO4)3(写出电离方程式)
(4)H+ + OH- = H2O(写出对应的化学方程式)
(5)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:Cu2+和
B组:
(化学与技术,15分)以黄铁矿为原料,采用接触法生产硫酸的流程可简示如图1:
请回答下列问题:
(1)在炉气制造中,生成SO2的化学方程式为 ;
(2)炉气精制的作用是将含SO2的炉气 、 和干燥,如果炉气不经过精制,对SO2催化氧化的影响是 ;
(3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图2所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 ;
(4)在SO2催化氧化设备中设置热交换器的目的是 ,从而充分利用能源。
(14分)工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,其生产工艺简略如下:
(1)反应器中反应的化学方程式为 。
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量 (填“偏高”或“偏低”)。
(3)电解槽中阳极的电极反应方程式为 。
(4)在传统工艺中得到K2MnO4后,向其中通入CO2反应生成黑色固体、KMnO4等,反应的化学反应方程式为 。根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工艺相比,电解法的优势是 。
(5)用高锰酸钾测定某草酸结晶水合物的纯度:称量草酸晶体样品0.250g溶于水,用0.0500mol·L-1的酸性KMnO4溶液滴定(杂质不反应),至溶液呈浅粉红色且半分钟内不褪去,消耗KMnO4溶液15.00 mL,则该草酸晶体的纯度为________。(已知该草酸结晶水合物H2C2O4·2H2O的式量为126)
不饱和酯类化合物在药物、涂料等领域应用广泛。由炔烃直接制备不饱和酯的一种新方法如下:反应①
(1)下列有关化合物Ⅰ~Ⅲ的叙述中,正确的是_ __。
| A.化合物Ⅰ能使酸性高锰酸钾溶液和溴水褪色 |
| B.化合物Ⅰ、Ⅱ、Ⅲ都能发生取代反应、加成反应、消去反应和加聚反应 |
| C.化合物Ⅰ的所有碳原子可能都处于同一平面上 |
| D.1mol化合物Ⅲ最多能与4molNaOH反应 |
(2)化合物Ⅲ的分子式为__________,1mol该化合物最多能与_____molH2完全反应。
(3)化合物Ⅳ是化合物Ⅲ的同分异构体,且满足以下条件,写出化合物Ⅳ结构简式___ (任写其中一种)
①能发生银镜反应,该化合物与银氨溶液反应的物质的量之比为1:4
②该化合物在与NaOH乙醇溶液共热能发生消去反应
③该化合物的核磁共振氢谱有四组峰,其峰面积比为6:2:2:1
④该化合物遇到FeCl3溶液显紫色
(4)化合物Ⅴ是用于制备高聚物 涂料的单体,化合物Ⅴ单体结构简式为______ 。该高聚物完全水解的化学方程式为 。利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 。
涂料的单体,化合物Ⅴ单体结构简式为______ 。该高聚物完全水解的化学方程式为 。利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 。
某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。
(1)由图中数据分析,该反应的化学方程式为:
(2)反应从开始至2min内X的平均反应速率是:
(3)反应过程中Y的转化率:
(4)2min后图像所表示的含义
有机物对香豆酸( )主要用于配置香辛樱桃、杏、蜂蜜等香料。
)主要用于配置香辛樱桃、杏、蜂蜜等香料。
(1)写出对香豆酸的分子式 。
(2)下列关于对香豆酸的说法不正确的是 。
a.能与NaOH溶液反应
b.能发生加成、取代、银镜反应
c.加金属钠,有氢气生成
d.加FeCl3溶液,溶液显紫色
(3)对香豆酸的某种同分异构体丁,可用于除草剂苯嗪草酮的中间体,其可通过下图转化关系制得。
①乙→丙的反应类型 ;
②乙分子所含官能团是 (填名称);
③丙→丁的反应化学方程式: ;
(4)有机物戊与丁互为同分异构体,且满足以下特点:
①是苯的对位取代物,
②能与NaHCO3反应放出气体,
③能发生银镜反应。
请写出化合物戊的结构简式 (任写一个即可)。
松油醇是一种调香香精,是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(18O是氧原子的一种同位素)经下列反应制得:
(1)α-松油醇的分子式为 。
(2)写出α-松油醇中官能团的名称 。
(3)α-松油醇能发生反应的类型有 。
| A.加成反应 | B.消去反应 | C.氧化反应 | D.取代反应 |
(4)物质M是A的一种同分异构体,写出该物质在Cu作催化剂的条件下和氧气反应的化学方程式 。
(5)写出下列物质的结构简式:β-松油醇 。
(原创)三聚氰胺(化学式:C3N6H6)是一种重要有机化工原料。下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺——“常压气相一步法联产纯碱新技术”: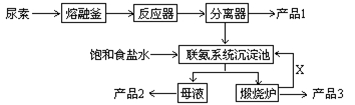
已知:以尿素为原料生产三聚氰胺的原理是:6 CO(NH2)2 C3N6H6 +6 NH3+3CO2
C3N6H6 +6 NH3+3CO2
请回答:
(1)尿素的结构式为
(2)已知:产品1是本工艺的主产品,产品2是副产品,X为循环使用的物质,产品3为纯碱。写出各主要成份的化学式:产品1 产品2 X
(3)联氨系统沉淀池中发生的化学反应方程式为:
(4)为了使母液中析出更多的产品2 ,常用的方法是
| A.加入固体NaCl | B.加入固体NaHCO3 |
| C.通入CO2气体 | D.通入NH3 |
(5)若生产过程中有4%的尿素损耗,每吨尿素理论上可得副产品纯碱 吨(精确到0.001)
【化学—化学与技术】选考海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、 池和结晶池。
②工业上通常以NaCl 、CO2和 NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式 。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
Ⅰ.电渗析法淡化海水中阴极室可获得的重要化工原料有 。
II.上图中虚线部分表示 离子交换膜。 淡水从 (A或B)排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
Ⅰ.写出反应③的离子方程式为 。
II.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液? 。
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
试题篮
()