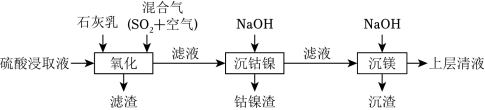
某工厂采用如图工艺处理镍钴矿硫酸浸取液(含 和 )。实现镍、钴、镁元素的回收。
已知:
|
物质 |
Fe(OH)3 |
Co(OH)2 |
Ni(OH)2 |
Mg(OH)2 |
|
Ksp |
10﹣37.4 |
10﹣14.7 |
10﹣14.7 |
10﹣10.8 |
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为 __________(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ), 中过氧键的数目为__________。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应的离子方程式为__________( 的电离第一步完全,第二步微弱);滤渣的成分为 、__________(填化学式)。
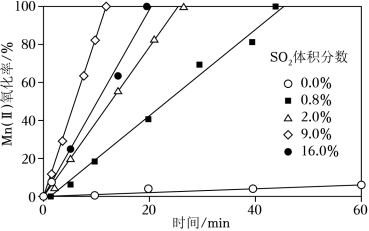
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如图。 体积分数为__________时, (Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是__________。
(5)“沉钴镍”中得到的 (Ⅱ)在空气中可被氧化成 ,该反应的化学方程式为__________。
(6)“沉镁”中为使 沉淀完全( ),需控制 不低于__________(精确至 )。
阿佐塞米(化合物L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L的一种合成路线如图(部分试剂和条件略去)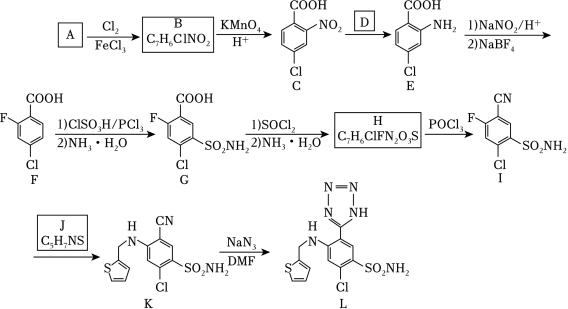
已知:R﹣COOH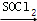 R﹣COCl
R﹣COCl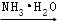 R﹣CONH2
R﹣CONH2
回答下列问题:
(1)A的化学名称是 。
(2)由A生成B的化学方程式为 。
(3)反应条件D应选择 (填标号)。
a.HNO3/H2SO4
b.Fe/HCl
c.NaOH/C2H5OH
d.AgNO3/NH3
(4)F中含氧官能团的名称是 。
(5)H生成I的反应类型为 。
(6)化合物J的结构简式为 。
(7)具有相同官能团的B的芳香同分异构体还有 种(不考虑立体异构,填标号)。
a.10
b.12
c.14
d.16
其中,核磁共振氢谱显示4组峰,且峰面积比为2:2:1:1的同分异构体结构为 。
甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g)═2O3(g)ㅤK1ㅤΔH1=285kJ•mol﹣1
②2CH4(g)+O2(g)═2CH3OH(l)ㅤK2ㅤΔH2=﹣329kJ•mol﹣1
反应③CH4(g)+O3(g)═CH3OH(l)+O2(g)的ΔH3= kJ•mol﹣1,平衡常数K3= (用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应MO++CH4═M++CH3OH,结果如图所示。图中300K的曲线是 (填“a”或“b”)。300K、60s时MO+的转化率为 (列出算式)。
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如图所示(两者历程相似,图中以CH4示例)。
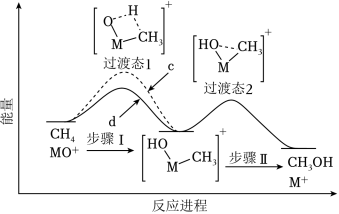
(i)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是 (填“Ⅰ”或“Ⅱ”)。
(ii)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线 (填“c”或“d”)。
(iii)MO+与CH2D2反应,氘代甲醇的产量CH2DOD CHD2OH(填“>”“=”或“<”)。若MO+与CHD3反应,生成的氘代甲醇有 种。
BaTiO3是一种压电材料。以BaSO4为原料,采用下列路线可制备粉状BaTiO3。
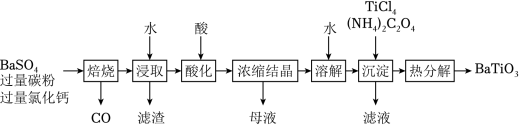
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是 。
(2)“焙烧”后固体产物有BaCl2、易溶于水的BaS和微溶于水的CaS。“浸取”时主要反应的离子方程式为 。
(3)“酸化”步骤应选用的酸是 (填标号)。
a.稀硫酸
b.浓硫酸
c.盐酸
d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?其原因是 。
(5)“沉淀”步骤中生成BaTiO(C2O4)2的化学方程式为 。
(6)“热分解”生成粉状钛酸钡,产生的 。
炎热的夏天暴雨之前,空气中水蒸气含量大,气压低,鱼因缺氧出现翻塘死鱼现象,若不及时人工增氧会使鱼大量死亡,造成经济损失,请说明鱼塘翻塘缺氧的原因。
CO不仅是家用煤气的主要成分,也是重要的化工原料。下图是用某些简单有机物在低温、低压和催化剂存在下合成具有优良性能的装饰性高分子涂料、黏胶剂的基本过程。
已知CaC 2 与水反应的化学方程为CaC 2 +2H 2 O  Ca(OH) 2 +HC≡CH↑。回答下列问题:
Ca(OH) 2 +HC≡CH↑。回答下列问题:
(1)写出G的结构简式。
(2)写出图中生成CH 3 OH(甲醇)的化学方程式。写出在浓硫酸作用下生成H的化学方程式。
(3)指出上述工艺的优点是什么?
Ⅰ、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)写出反应的化学方程式 。
(2)根据上述反应可推知______________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3
Ⅱ、2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。
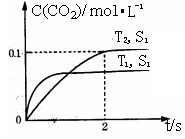
据此判断:
①该反应的△H 0(填“>”、“<”)。
②在T2温度下,0~2s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到t1时刻达到平衡状态的是 (填代号) 。
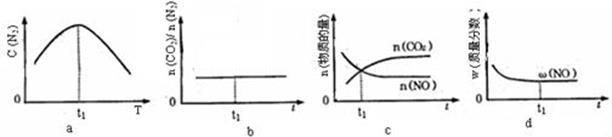
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)  N2O4(g) ΔH2=-56.9 kJ/mol
N2O4(g) ΔH2=-56.9 kJ/mol
写出CH4 (g)催化还原N2O4(g)生成N2 (g)和H2O (g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。

某一氯代烷1.85g,与足量的氢氧化钠溶液混合后加热,充分反应后,用足量硝酸酸化,向酸化后的溶液中加入20mL 1mol•L﹣1AgNO3溶液时,不再产生沉淀.
(1)通过计算确定该一氯代烷的分子式_____________________
(2)写出这种一氯代烷符合下列条件的结构简式:
①核磁共振氢谱有4组峰 ②水解产物经催化氧化生成醛类
某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、NH4+、Cl-、CO32-和SO42-。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.672L(标准状况下),但整个过程中无沉淀生成。
③第三份加入足量BaCl2溶液后得干燥沉淀6.63g,沉淀经足量盐酸洗涤,干燥后剩余4.66g。
请回答:
(1)c(CO32-)=______ mol/L。
(2)K+是否存在?_____ (填“存在”或“不存在”);若存在,浓度范围是________ (若不存在,则不必回答第2问)。
(3)根据以上实验,不能判断哪种离子是否存在? ,若存在,这种离子如何进行检验?
有一包白色固体粉末,由CaCO3、Na2SO4、KCl、Ba(NO3)2、CuSO4中的几种物质组成,取样品进行如下实验(假设下列过程中,能反应的物质之间的反应恰好完全):

(1)步骤“①”所用分离方法叫做 ,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做 。
(2)写出实验过程中发生化学反应的离子方程式 。
(3)固体粉末中一定不存在的物质是(填化学式,下同) ;一定存在的物质是 。
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
| 序号 |
化 学 式 |
| Ⅰ |
|
| Ⅱ |
|
| Ⅲ |
|
(5)设计一个实验,进一步确定混合物的组成,简述实验操作、现象和结论。
试题篮
()