把3.06 g铝和镁的混合物粉末放入100mL盐酸中,恰好完全反应,并得到标准状况下3.36LH2。请计算:
(1)该合金中铝的物质的量;(2)该合金中镁的质量;(3)盐酸的物质的量浓度。
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L。
请回答下列问题:
(1)求参加反应的二氧化锰的质量。
(2)求反应中被氧化的HCl的物质的量。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,求该浓盐酸中HCl的物质的量浓度。
室温下,250 mL pH=12的某一元强碱(MOH)溶液与250 mL 0.025 mol·L-1的硫酸溶液相混合,假设混合后液体体积为500 mL。试求:
(1)混合液的pH;
(2)若原250 mL的一元强碱中含溶质0.1 g,则M的相对原子质量为多少?
计算题:
(1)标准状况下,22.4 L HCl气体溶于水,配制成250 mL盐酸,所得溶液中氯化氢的物质的量浓度?若将该盐酸稀释成1 L溶液A,则其溶质的物质的量浓度?
(2)从溶液A中取出250mL盐酸与足量Zn反应,标准状况下生成H2的体积?(根据化学方程式计算)
在100mL某浓度的CuSO4溶液中加入一质量为45.0g的铁棒,反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g。
(1)写出该反应的离子方程式。
(2)反应掉的铁的质量为多少克?
(3)若反应后溶液的体积不变,求所得溶液中FeSO4的物质的量浓度。
硝酸与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径。
完成下列计算:
52.合成氨时,假设100L的氮气与氢气(体积比为1 : 3)的混合气体通过氨合成塔充分反应后,体积变为90L,则氮气的转化率为 。(写出计算过程,计算结果请用百分数表示)
53.标准状况下,将500L氨气溶于1L水中形成氨水,则此氨水质量分数为 。(写出计算过程,计算结果请用百分数表示,并保留1位小数)
54.氨氧化法是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。此时温度很高,水以水蒸气的形式存在,NO也不与O2反应。若氨气与氧气物质的量之比为1:1.7时,氨的转化率可达95%,计算反应后NO的体积分数 。(设氧气在空气中的体积分数为20%,写出计算过程,计算结果请用百分数表示并保留1位小数)
55.一氧化氮继续氧化为二氧化氮,二氧化氮溶于水可得硝酸。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。( 已知金不溶于浓硝酸)
填写该18K金的成分表(写出计算过程,计算结果请用百分数表示并保留1位小数,若不含该金属则填0)。
| 18K金成分 |
Au |
Ag |
Cu |
| 含量(质量分数) |
75 % |
_________ |
_________ |
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25 氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求:
氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求: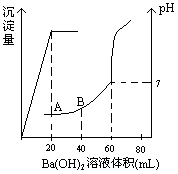
(1)滴定前盐酸和硫酸的物质的量浓度各为多少?
(2) 在B点时的pH是多少?(已知lg2=0.3)
(无计算过程不得分)
等物质的量的CO和CO2中所含O原子个数之比 ,在同温同压下的体积之比 。在100ml AL2(SO4)3溶液中, mol AL2(SO4)3中含0.6molSO42-,其中含Al3+ 个,从中取出10ml的该溶液再稀释到100 ml,则稀释后的溶液中SO42-的物质的量浓度为 。
实验室常用的浓盐酸的密度为1.17 g·mL-1,质量分数为36.5%。
试计算:
(1)此浓盐酸的物质的量浓度是多少?
(2)取此浓盐酸50 mL,用蒸馏水稀释到250 mL,稀释后盐酸的物质的量浓度是多少?
10 g Mg、Al合金与足量100 mL NaOH溶液反应,产生H2的体积为6.72 L(标准状况下),求:
(1)合金中Al的质量分数;
(2)生成物NaAlO2的物质的量浓度(假设溶液体积不变)
(1)H2SO4的摩尔质量为 ;0.3mol的NH4+中含有 个电子;
(2)①标准状况下22.4 L CH4 ②1.5 mol NH3 ③1.806×1024个H2O ④标准状况下73g HCl所含H原子个数由多到少的顺序为 (填序号);
(3)在含0.4 mol Al2(SO4)3的溶液中SO42-的物质的量为 ;
(4)某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是 ;
(5)取100 mL a mol / L HCl溶液与300 mL n mol / L H2SO4溶液均注入到500 mL的容量瓶中,加水稀释到刻度线,则该混合溶液中H+ 的物质的量浓度为 mol / L;
试题篮
()