砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) 的熔点高于1000℃, 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 , 其晶胞结构如图所示.
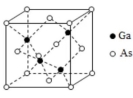
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 和 , 原子半径分别为 和 ,阿伏伽德罗常数值为 ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
天然气的主要成分为CH 4,一般还含有C 2H 6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C 2H 6(g)═C 2H 4(g)+H 2(g)△H 1,相关物质的燃烧热数据如下表所示:
| 物质 |
C 2H 6(g) |
C 2H 4(g) |
H 2(g) |
| 燃烧热△H/(kJ•mol ﹣ 1) |
﹣1560 |
﹣1411 |
﹣286 |
①△H 1= kJ•mol ﹣ 1。
②提高该反应平衡转化率的方法有 、 。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α.反应的平衡常数K p= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH 4 C 2H 6+H 2.反应在初期阶段的速率方程为:r=k×c ,其中k为反应速率常数。
①设反应开始时的反应速率为r 1,甲烷的转化率为α时的反应速率为r 2,则r 2= r 1。
②对于处于初期阶段的该反应,下列说法正确的是 。
A.增加甲烷浓度,r增大
B.增加H 2浓度,r增大
C.乙烷的生成速率逐渐增大
D.降低反应温度,k减小
(3)CH 4和CO 2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
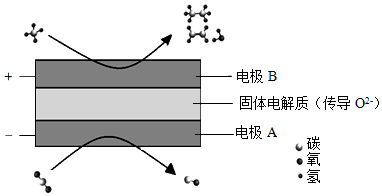
①阴极上的反应式为 。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH 4和CO 2体积比为 。
将0.1mol某烃的衍生物与标准状况下4.48L氧气混合密闭于一容器中,点火后发生不完全燃烧,得到CO2、CO和H2O的气态混合物。将混合气体通过浓硫酸时,浓硫酸质量增加了3.6g,通过澄清石灰水时,可得到沉淀10g (干燥后称量)。剩余气体与灼热的氧化铁充分反应后再通入澄清的石灰水中,又得到20g固体物质(干燥后)。
求:(1)该有机物的分子式。
(2)该有机物可与醇发生酯化反应,且可使溴水褪色,写出有机物的结构式。
计算题(写出解题过程)
一定质量的金属铜,加入50mL10mol/L的浓硝酸充分反应后,铜完全溶解,共放出标准状况下的气体4.48L。
(1)若气体只有NO2,计算铜的质量。
(2)若气体为NO2和NO,且硝酸也恰好完全反应,计算铜的质量。
已知某温度下,醋酸的电离常数K=1.6×10-5。计算0.010mol/L的醋酸溶液中,c(H+)是多少?
0.1mol某烃的衍生物与0.35mol氧气混合密闭于一容器中,点火后发生不完全燃烧,得到CO2、CO和H2O的气态混合物。将混合气体通过浓硫酸时,浓硫酸质量增加了5.4g,通过足量澄清石灰水时,可得到沉淀20g(干燥后称量)。剩余气体与灼热的氧化铁充分反应后再通入足量澄清的石灰水中,又得到20g固体物质(干燥后)。
求:(1)该有机物的分子式。
(2)该有机物可与醇发生酯化反应,且可使溴水褪色,写出该有机物可能的结构简式和名称。
将8.8g 硫化亚铁固体置于200 mL 2.0 mol/L的盐酸中,以制备H2S气体。反应完全后,溶液中H2S的浓度为0.10 mol/L(假定溶液体积不变)。试计算在标准状况下,可收集到H2S气体的体积是多少L。
为测定某碳酸钠样品的纯度,取一定质量碳酸钠样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224mL(标准状况下)。计算:
(1)该碳酸钠样品中碳酸钠的质量是。
(2)盐酸的物质的量浓度是。
CaCO3是一种难溶物质,其Ksp=2.8×10-9 , 先将等体积的Na2CO3溶液与CaCl2溶液混合,若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为多少?(写出计算过程)
将7.8 g镁铝合金加到足量的氢氧化钠溶液, 充分反应放出气体6.72 L(标准状况下)。请计算
(1)合金中镁的物质的量;
再将7.8 g该镁铝合金与500 mL硫酸溶液恰好完全反应,请计算
(2)原硫酸物质的量浓度。
取100 mL Na2CO3和Na2SO4的混合溶液,加过量BaCl2溶液后得到16.84g白色沉淀,沉淀用过量稀HNO3处理质量减少到6.99g,并有气体放出。试计算:
(1)原混合溶液中Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积。
将一份CaCO3粉末放入500mL的盐酸中,恰好完全反应,在标准状况下收集到的CO2气体体积为22.4L,求
1)CaCO3的质量。 (2)盐酸物质的量浓度。
试题篮
()